Herkulesaufgabe für die Pharmawirtschaft
Neue Sicherheitsmerkmale zum Fälschungsschutz von Arzneimitteln erfordern veränderte Prozesse
Pharmazeutische Unternehmen in Europa stehen derzeit vor einer Herkulesaufgabe. Die EU-Verordnung Nr. 2016/161 zur Umsetzung der Fälschungsschutzrichtlinie fordert, dass ab 9. Februar 2019 jede Packung eines verschreibungspflichtigen Arzneimittels mit zwei Sicherheitsmerkmalen zu versehen ist. Ziel ist es, den Schutz des Patienten vor gefälschten Arzneimitteln in der legalen Lieferkette auf dem schon hohen europäischen Niveau auch in Zukunft zu sichern. Jedes pharmazeutische Unternehmen, das verschreibungspflichtige Arzneimittel für den europäischen Markt im Portfolio hat, muss reagieren und seine Produktion auf die neuen gesetzlichen Anforderungen umstellen. Der Countdown läuft und damit steigt der Druck.
Die zwei von der EU-Gesetzgebung geforderten Sicherheitsmerkmale sind eine Vorrichtung gegen Manipulation sowie das individuelle Erkennungsmerkmal. Letzteres ist die Grundlage für die Echtheitsprüfung. Es ist eine zufällig generierte Seriennummer in Verbindung mit dem jeweiligen Produkt-Code, die jede Packung zum Unikat macht.
Technisches System im Aufbau
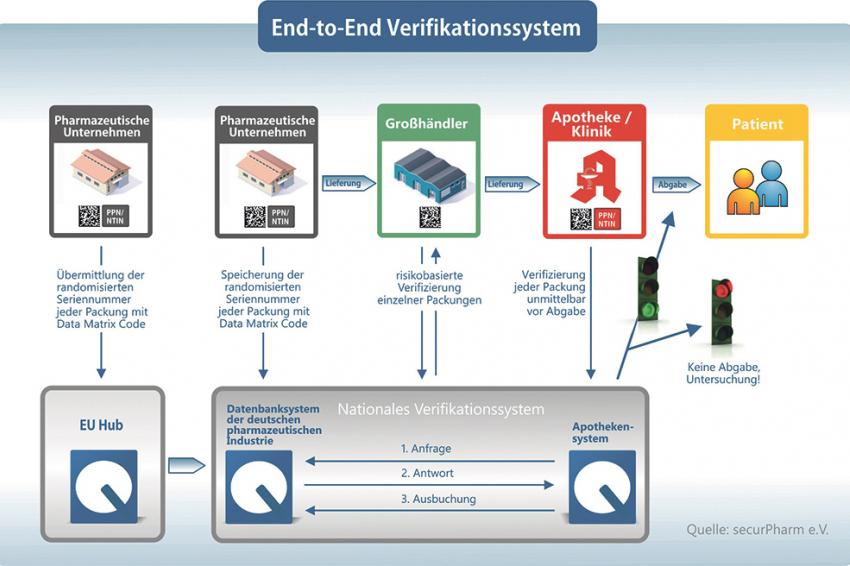
SecurPharm als National Medicines Verification Organisation baut in Deutschland das gleichnamige technische System zur Echtheitsprüfung von Arzneimitteln auf und sorgt für die Anbindung an den EU-Hub. Über die SecurPharm-Subsysteme, die die Datenbanken für pharmazeutische Unternehmen sowie Großhändler und Apotheker betreiben, können sich die Akteure der Arzneimittelwirtschaft an SecurPharm anbinden. Hersteller nutzen dafür die Datenbank der pharmazeutischen Industrie. Großhändler, Apotheker und Krankenhäuser binden sich über das Apothekensystem an. Strikte Arbeitsgrundlage sind die gesetzlichen Vorgaben von Fälschungsschutzrichtlinie und delegierter Verordnung.
Mit Aufgabenteilung zum Ziel
Die Aufgaben beim Aufbau eines Schutzschildes gegen gefälschte Arzneimittel sind unterschiedlich verteilt. Aufgabe von SecurPharm ist es, den Marktteilnehmern ein den gesetzlichen Vorgaben entsprechendes technisches System für die Echtheitsprüfung zur Verfügung zu stellen. Die Verbände klären offene Punkte, die sich aus den Rechtstexten oder Besonderheiten der Lieferstufe ergeben, mit dem nationalen und europäischen Gesetzgeber und erarbeiten gesetzeskonforme Lösungen. In der Verantwortung der Systemnutzer liegt es, die internen Voraussetzungen für die Arzneimittelverifizierung zu schaffen und sich rechtzeitig an das technische System anzuschließen. Nur, wenn jeder Akteur seinen Teil beiträgt, wird sich die von der Fälschungsschutzrichtlinie gestellte Herkulesaufgabe bewältigen lassen.
Grundstrukturen stehen
SecurPharm ist mit dem Aufbau des technischen Systems weit fortgeschritten. Der Fokus der Arbeit liegt nun auf der Klärung von Detailfragen bzw. von Themen einzelner Nutzergruppen. Es geht etwa um die Modalitäten zur Klärung von Verdachtsfällen, die in Abstimmung mit den Behörden erarbeitet werden. Ein weiteres wichtiges Thema ist die Gestaltung von Multi Market Packs. Außerdem werden Lösungen für das krankenhaustypische Handling großer Packungsmengen erarbeitet. Wesentliches Merkmal der Arbeitsweise von SecurPharm ist es, gemeinsam mit den Nutzern des Systems marktkompatible Lösungen zu finden. Im Jahr 2018 soll der Aufbau des nationalen Verifikationssystems abgeschlossen sein.
Datenbanksystem der Pharmaindustrie steht bereit
Das technische System von ACS PharmaProtect (ACS), dem Betreiber der Datenbank der pharmazeutischen Industrie bei SecurPharm, steht bereit, um pharmazeutische Unternehmen anzuschließen. 100 Unternehmen nutzen diese Chance bereits. Sie können die von Apothekern und Großhändlern für die Echtheitsprüfung benötigten Daten hoch laden und profitieren von dem durch ACS organisierten Wissensaustausch. Jeder pharmazeutische Unternehmer, der in Deutschland verschreibungspflichtige Arzneimittel vertreibt, muss einen Vertrag mit ACS schließen.
Ein unternehmensweites Change-Projekt
Der Umsetzungsaufwand der Fälschungsschutzrichtlinie insbesondere für die Hersteller wird vielfach noch unterschätzt. Die größte Herausforderung ist die fehlerfreie und rechtzeitige Bereitstellung der Packungsdaten für die Echtheitsprüfung. Stehen diese Daten bei der Abgabe nicht zur Verfügung, dürfen diese Packungen nach dem 9.2.2019 nicht mehr abgegeben werden.
Spätestens bis Anfang 2018 sollten sich pharmazeutische Unternehmen an die Datenbank der pharmazeutischen Industrie angebunden haben. Sie haben dann noch ein Jahr Zeit, die internen Prozesse für die erfolgreiche Arzneimittelverifizierung zu trainieren und das Personal auf die neuen Anforderungen zu schulen. Auftretende Fehler während dieser Trainingsphase führen nicht zum Geschäftsausfall, sondern bieten Raum für Anpassungen und Nachbesserungen. Eine einjährige Trainingsphase ist sicherlich der Idealfall, wird aber empfohlen. Die bisherigen Erfahrungen zeigen, dass für Unternehmen diese Testphase hilfreich ist, um die neuen Verifizierungsprozesse zuverlässig in den Griff zu bekommen.
Serialisierungsmanagement erfordert neue Prozesse
Fast alle Prozesse in allen Bereichen eines Unternehmens müssen angepasst werden. Beginnend mit dem Aufbringen der Sicherheitsmerkmale über die interne Qualitätskontrolle bis hin zur Chargenfreigabe, dem Management der Serialisierungsdaten und dem damit verbundenen Hochladen dieser Daten. Auch die Anforderungen an die Packmittel ändern sich, da das Aufbringen des Data Matrix Code an der Linie typischerweise eine Lackfreifläche erfordert. Hinzu kommen Veränderungen am Packungsdesign für die Anbringung des Sicherheitsverschlusses. In Deutschland müssen über 50.000 Packungslayouts überprüft bzw. angepasst werden. Weltweit muss jede Linie, die für den europäischen Markt verifizierungspflichtige Arzneimittel produziert, umgerüstet werden.
Die Schwierigkeit bei der Prozessumstellung auf Serialisierung liegt in der zuverlässigen Verwaltung der Daten. Sobald es mehrere Produktionsstätten gibt oder ein Lohnhersteller eingebunden ist, müssen Seriennummern standortübergreifend verwaltet werden. Die Seriennummer unterliegt zwei konträren Anforderungen. Sie muss zuverlässig verfügbar sein, damit die Produktion nicht ins Stocken gerät, aber gleichzeitig muss sie geschützt werden, um einen unbefugten Zugriff darauf zu vermeiden.
Das Handling der Seriennummer ist mit dem Aufbringen nicht beendet. Nächster Schritt ist der Abgleich der zur Verfügung gestellten Seriennummern mit den tatsächlich in der Produktion verwendeten. Außerdem sind Prozesse aufzusetzen, wie mit den nicht benötigten Seriennummern verfahren werden soll, d.h. es muss entschieden werden, ob sie entsorgt oder recycelt werden. Das gilt ebenfalls für Seriennummern, die sich auf Fehlproduktionen oder anderweitig aussortierten Packungen befinden. Nicht zuletzt gilt es zu beachten, dass der Zugriff auf alle Seriennummern für die Dauer der Haltbarkeit des jeweiligen Produktes (mit einer zusätzlichen Frist von einem Jahr) sichergestellt sein muss.
Fazit
Die sichere Beherrschung des Serialisierungsprozesses ist künftig Basis für den wirtschaftlichen Erfolg eines pharmazeutischen Unternehmers und kann sich – je näher der Stichtag rückt – als Wettbewerbsvorteil erweisen. Denn in einem Punkt ist die delegierte Verordnung deutlich: Ab 9.2.2019 dürfen vom Hersteller keine Arzneimittel mehr ohne die neuen Sicherheitsmerkmale in Verkehr gebracht werden!