Cannabis als Heilmittel
Der Weg über die GMP-Einführung zur Swissmedic-Bewilligung
Ai Fame betreibt in Wald-Schönengrund im Schweizer Kanton St. Gallen eine Produktionsstätte zum Züchten, Anbauen, Ernten und Weiterverarbeiten von Cannabispflanzen. Von den in der Literatur beschriebenen wenigen Grundstämmen und Sorten, hat das Unternehmen über 70 verschiedene Arten mittels Kreuzung und Züchtung entwickelt, um so je nach späterer Anwendung oder abhängig von der notwendigen Robustheit gegenüber äußeren Einflüssen und Schädlingen bzw. abhängig vom benötigten Wirkeffekt die „ideale" Pflanze zu haben. Außerdem ist es Ai Fame erstmals weltweit gelungen, die pflanzlichen Wirkstoffe der Cannabispflanze wasserlöslich und dadurch besser weiterverarbeitbar zu machen.
Zurzeit werden die verschiedenen Bestandteile der indoor angebauten Cannabispflanzen (u.a. Blätter, Blüten, Blütenstaub und Samen) schon für verschiedene Produkte im Lebensmittelbereich, z.B. zur Herstellung von Likör (Setino) oder als Sud zur Schädlingsbekämpfung im Agrarbereich verwendet. Zukünftig sollen aus den Blüten und Blättern der Cannabispflanzen durch Hochdruckextraktion die verschiedenen Inhaltsstoffe gewonnen und als Wirkstoffe entwickelt sowie für die pharmazeutische Industrie zugelassen und am Markt angeboten werden. Die Herstellung und der Vertrieb pharmazeutischer Wirkstoffe (APIs) erfordert jedoch in der Schweiz außer der Einführung von GMP eine Betriebsbewilligung durch die Swissmedic. Dazu hat Ai Fame das GMP Beratungs- und Dienstleistungsunternehmen Gempex mit seiner Schweizer Zweigniederlassung in Laufenburg federführend mit der Umsetzung aller hierfür notwendigen Aktivitäten einschließlich Vorbereitung und Begleitung der Behördeninspektion betraut.
Die Herausforderung
Damit waren als wesentliche Aufgaben vorgegeben: die Durchführung einer GMP-Studie zur regulatorischen Einstufung der Roh- und Wirkstoffe, die Einführung eines umfänglichen Qualitätsmanagementsystems mit allen notwendigen Anweisungen und Formularen, die Planung und Begleitung des Umbaus der Produktionsstätte und letztendlich die Beantragung und Koordination der Bewilligung bei der Swissmedic. Weitergehend waren gefordert das komplette Projektmanagement einschließlich Übernahme der Funktion der fachtechnisch verantwortlichen Person sowie die Übernahme der Leitung Qualitätsmanagement. Die wesentliche Herausforderung innerhalb des Projektes bestand darin, dass ein bisher auf die Entwicklung ausgerichteter und in QM-Systemen unerfahrener Kleinbetrieb in einer pragmatischen und anforderungsgerechten Weise an GMP herangeführt werden musste.
Der erste Schritt zur Bewilligung
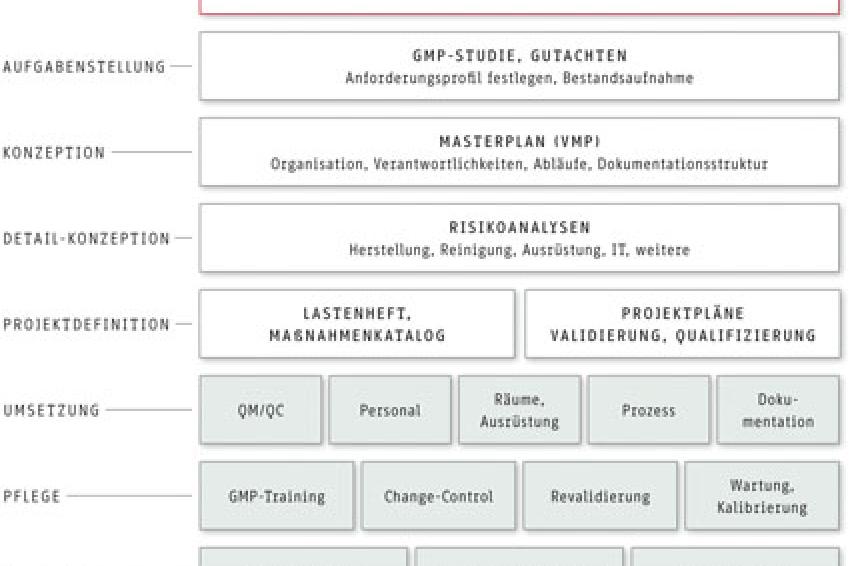
In der Anfangsphase des Projekts wurden zusammen mit dem Kunden alle erforderlichen Informationen beschafft, um eine umfängliche GMP-Studie bzw. ein GMP-Gutachten zu erstellen (vgl. Abbildung). Dieses hat zum Ziel, die Einstufung des Produktes hinsichtlich Produktart, Einsatzzweck und Spezifikation vorzunehmen, aber auch Festlegungen zu treffen, die den GMP-Startpunkt und GMP-Umfang betreffen. Dazu gehört es auch, Gefahren hinsichtlich möglicher chemischer, physikalischer oder mikrobieller Verunreinigungen aufzeigen. Um weitere qualitätskritische Parameter bei der Produktion des Cannabisrohstoffs bzw. des späteren Wirkstoffes unter GMP-Aspekten zu identifizieren und erforderliche qualitätssichernde Maßnahmen festlegen zu können, wurden die bestehende Produktionsstätte inkl. der Aufzucht und Blütenräume, die bisherigen Aktivitäten zur Qualitätssicherung und Qualitätskontrolle, sowie die vorhandene Dokumentation hinsichtlich ihrer GMP-Konformität in einem auditähnlichen Vorgehen betrachtet. Diese GMP-Studie wurde später als ein wesentlicher Bestandteil den Anträgen auf Erteilung einer Bewilligung durch die Swissmedic hinzugefügt.
Parallel dazu wurden bei der Implementierung des Qualitätsmanagementsystems, das die grundsätzlichen Vorgaben und Richtlinien zur qualitätsbewussten Herstellung und Prüfung der Produkte festlegen soll, erste Anweisungen zu den Themen Qualitätsmanagement, Dokumentation, Produktion, Lagerung, Verteilung und Handel, Qualitätskontrolle sowie Personal erstellt. Auch hier bestand aufgrund der Firmengröße und Personalstärke von Ai Fame die Kunst darin, pragmatische und erfüllbare Vorgaben zu definieren und dabei stets GMP-konform zu sein.
Die Risikoanalyse
Im Weiteren wurde zur vollständigen Identifizierung evtl. noch nicht erkannter Mängel und daraus resultierender Maßnahmen eine detaillierte Risikoanalyse zum gesamten Herstellverfahren des Cannabisrohstoffs durchgeführt. Dazu wurden die einzelnen Schritte, vom Schneiden der Stecklinge aus den Mutterpflanzen, über das An- und Aufzüchten, das zum Blühen bringen und das Pflegen der Cannabispflanzen bis hin zum Sortieren und Verpacken des Rohstoffs, betrachtet und intensiv diskutiert. Aus der Risikoanalyse ergaben sich technische und organisatorische Maßnahmen, die u.a. in die Erstellung weiterer Anweisungen einflossen oder Auswirkungen auf den Umbau der Produktionsstätte hatten. Weiter wurden auch Maßnahmen zur Qualifizierung der Ausrüstung und Validierung der Verfahren festgelegt.
Der Hygienemasterplan
Der Hygienemasterplan wurde als ein weiterer wichtiger Baustein im Rahmen der Bewilligung innerhalb dieser Phase definiert. Der Hygienemasterplan definiert Zonen mit unterschiedlichen Anforderungen an die verschiedenen Hygienemaßnahmen hinsichtlich Kleiderordnung und Personalhygiene, Personal- und Materialfluss, bauliche Ausführung, Reinigung der Räumlichkeiten sowie der notwendigen Luftqualität. Die Definition der insgesamt fünf verschiedenen Hygienezonen erfolgte aufgrund der Anforderungen an das herzustellende bzw. zu handhabende Produkt (nicht sterile APIs und deren Rohstoffe). Die räumlichen und technischen Anforderungen für den Umbau der Produktionsstätte flossen danach in das betriebliche Lastenheft.
Stand der Dinge
Die ersten Schritte sind gemacht: die wichtigsten Anweisungen zum Qualitätsmanagement, darunter auch das Qualitätsmanagementhandbuch, sind erstellt und in Kraft. Die Betriebsbewilligung ist bei der Swissmedic beantragt und der erste Termin zur Besichtigung durch das Heilmittelinspektorat wird mit Spannung erwartet.
Ausblick
In der Zwischenzeit werden in den nächsten Projektphasen die erforderlichen Anweisungen zur Herstellung, zur Technik und zur Validierung erstellt und neben dem Vorantreiben des Umbaus, die Qualifizierung erster Ausrüstungen in Angriff genommen.
Das Ziel ist es, die Betriebsbewilligung Ende 2010 noch ohne die Zulassung des eigentlichen Wirkstoffs zu erhalten und bis dahin auch erste Partner in der pharmazeutischen Industrie gefunden zu haben, die an der Entwicklung und späteren Verwendung der Wirkstoffe aus dem Cannabisextrakt Interesse haben. Zusammen mit diesen Partnern sollen dann die nächsten Schritte zur Entwicklung und Zulassung des Wirkstoffs sowie zur Anwendung in einem Arzneimittel gegangen werden.
Die Wirkstoffe der Cannabispflanze

Cannabis wurde schon vor tausenden von Jahren bei vielen Völkern als Heilmittel verwendet. Die wichtigsten Wirkstoffe der Cannabispflanze sind die fünf Cannabinoiden, ∆9-Tetrahydrocannabinol (THC), Cannabidiol (CBD), Cannabinol (CBN), Cannabigerol (CBG) und Cannabichromen (CBC). Dabei haben die einzelnen Cannabinoide unterschiedliche Wirkungen, die den Cannabisextrakt für eine pharmazeutische Verwendung interessant machen. Die größte Wirkung hat der Hauptwirkstoff THC. Er wird u.a. als euphorisierend, appetitsteigernd, muskelentspannend, schmerzhemmend und antiepileptisch beschrieben. Die größte Konzentration an Wirkstoffen findet sich in den Blütenblättern und im Harz der weiblichen Cannabispflanze.
Die IACM (International Association for Cannabinoid Medicines) sieht mögliche Anwendungsgebiete für Cannabisextrakte in der Behandlung von MS-Patienten zum Lösen von Muskelkrämpfen und Lindern von Schmerzen oder bei der unterstützenden Behandlung von HIV Infizierten und von Krebspatienten während der Chemotherapie zum Lindern der Übelkeit und Anregen von Appetit. Aber auch bei der Behandlung von grünem Star kann Cannabisextrakt durch die Senkung des Augeninnendrucks zur Anwendung kommen.
Gempex GmbH
Zweigniederlassung Laufenburg
Im Bifang 2
CH-5080 Laufenburg
Kontakt
gempex GmbH - Zweigniederlassung Laufenburg
Im Bifang 2
5080 Laufenburg
Schweiz
+41 62 87420 83
+41 62 87420 84