Qualität und Wirtschaftlichkeit in der Pharmaproduktion
Prozessanalysetechnik als Schlüssel zu Quality by Design
Globalisierung und Veränderungen in der Marktdynamik stellen die Pharmaindustrie vor eine Vielzahl komplexer Herausforderungen. Strengere gesetzliche Vorschriften machen kontinuierliche Investitionen in Produktverfolgung und Dokumentation erforderlich. Die Pharmaindustrie investiert weitaus mehr als andere Industriezweige in Forschung und Entwicklung - jedes Jahr fließen enorme Summen in diesen Bereich, was einen starken Gegensatz zu den bisher vergleichsweise einfachen Produktionstechniken bildet.
Pharmahersteller müssen ihre Fertigungseffizienz steigern durch die Eindämmung von Kosten und durch Maßnahmen zur Verbesserung von Produktionsabläufen und Produktqualität. Die US-amerikanische Gesundheitsbehörde Food and Drug Administration (FDA) hat sich für eine entsprechende Initiative eingesetzt, die unter der Überschrift "Quality by Design" (QbD) bekannt ist und die Produktivität von Pharmaherstellern in den USA steigern soll. Diese Initiative ist politisch gewollt, weil man davon ausgeht, dass Medikamente unter anderem deshalb so teuer sind, weil die Herstellungsprozesse nicht effizient genug sind und eine Optimierung in diesem Bereich die allgemeinen Kosten im Gesundheitswesen senken kann.
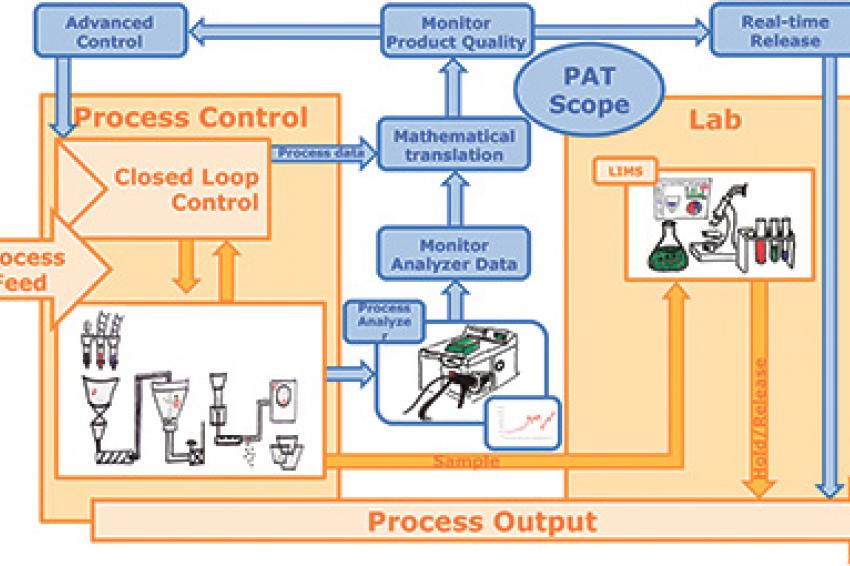
QbD lässt sich mit Hilfe von Prozessanalysetechnik (PAT) realisieren. Qualitätsvorgaben und kritische Prozessparameter werden dabei während der Produktion in Echtzeit gemessen; bei Abweichungen kann der Prozess dann ohne Betriebsunterbrechung justiert werden. Die Produktqualität und -spezifikationen werden mehrfach im Prozessverlauf und nicht erst durch eine Qualitätskontrolle am Endprodukt überprüft, so dass Chargen schneller freigegeben und Fehlproduktionen vermieden werden können. Die wirtschaftlichen Vorteile der PAT sind vielversprechend: Effizientere Systemauslastung, höhere Erträge, weniger Ausschuss, kürzere Vermarktungszyklen und ein hohes Maß an Prozesskontrolle.
Das Dilemma der Produktkontrolle
Bei der traditionellen Qualitätskontrolle wird überprüft, ob das fertige Medikament mit den vorher definierten Produktmerkmalen übereinstimmt. Im Falle einer Abweichung wird die Charge nicht freigegeben. Die Qualität der Rohmaterialien und des Endprodukts wird in einem streng festgelegten und kontrollierten Verfahren getestet, wobei neben den Produktspezifikationen auch noch auf viele weitere Qualitätsmerkmale zu achten ist. Der Nachteil dieser Methode liegt darin, dass übermäßig strenge Prüfvorgaben zu unnötigen Rückrufaktionen und/oder Lieferengpässen führen können. Gleichzeitig werden die eigentlichen Gründe für die Fehlproduktion meistens nicht vollständig aufgedeckt und es kann zu wiederholten Verlusten kommen.
Schon bei der Aufnahme der Produktion nach der Pilotphase erweist sich die herkömmliche Prüfmethodik als problematisch: Die Produktspezifikationen ergeben sich gewöhnlich aus Prüfdaten, die anhand von kleinen Chargen im Labor ermittelt werden. In der Serienproduktion kann es zu Bedingungen kommen, die in der Entwicklungsphase noch nicht abzusehen waren. Ist die Produktion erst einmal aufgenommen, müssen selbst geringfügige und schrittweise Änderungen an den Herstellungsprozessen per Nachtrag bei den Behörden eingereicht werden. Folglich ist die Prozessoptimierung und Echtzeit-Qualitätssicherung mit kontinuierlicher Datenrückführung äußerst schwierig.
Quality by Design
Mit Quality by Design (QbD) steht eine Methode zur Verfügung, mit der sich Produktqualität bereits in der Entwicklungsphase "einbauen" lässt. Anstatt Rohmaterialien und Endprodukte zu prüfen, geht es bei QbD darum, die Herstellungsprozesse so zu planen und kontinuierlich zu kontrollieren, dass die erforderliche Produktqualität jederzeit eingehalten wird.
Bei der Herstellung von Pharmazeutika bietet QbD eine wissenschaftliche, risikobasierte Methode der Produktentwicklung mit Hauptaugenmerk auf Prozessplanung und -kontrolle. Bei QbD wird definiert, welche Parameter für die Produktqualität maßgeblich sind und wann bzw. auf welche Weise sie kontrolliert werden. Die Methode konzentriert sich also auf die Bereiche, die wirklich wichtig sind und senkt das Fehlerrisiko bei den kritischen Parametern.
PAT: Der Schüssel zu "Quality by Design"
Bei Prozessanalysetechnik (PAT) werden Mess- und Evaluierungswerkzeuge verwendet, mit denen sich QbD realisieren lässt. Sensoren und Analysegeräte (z.B. NIR-Spektrometer) messen die Substanzeigenschaften bei laufender Produktion und leiten diese in Echtzeit zu Auswertungszwecken weiter. Eine Software setzt diese Daten zu Kennwerten der Produktqualität (CQA, Critical Quality Attributes) in Beziehung, so dass die Qualität der entsprechenden Charge abgeleitet und der laufende Prozess bei Abweichungen angepasst werden kann. Hierbei spielen Tools für die fortgeschrittene Prozesssteuerung (APC - Advanced Process Control) eine Rolle.
PAT unterstützt das QbD-Modell, weil die Planung, Analyse und Kontrolle von Prozessabweichungen in Form von zeitgerechten Messungen von kritischen Qualitäts- und Leistungsparametern an den Roh- und Zwischenprodukten durchgeführt werden - sowohl mit Hinblick auf die Herstellungsprozesse als auch in der Entwicklung. Mit Inline-Analysen erhalten Produktentwickler einen weitaus besseren und schnelleren Über-blick über den Prozess als bei manuellen Stichprobenuntersuchungen. Die Echtzeitinformationen, die sich durch PAT erfassen lassen, sind bei der pharmazeutischen Entwicklung und während des Übergangs zur Serienproduktion von unschätzbarem Wert.
PAT in der Produktentwicklung
Im Rahmen von QbD kann PAT bereits bei der Entwicklung eines neuen Produkts eingesetzt werden. Nachdem ein Wirkstoff im Labor abschließend entwickelt ist, werden im nächsten Schritt Dosierung und Formulierung (Tabletten, Kapseln, Zäpfchen) sowie sonstige Bestandteile festgelegt. All diese Faktoren zusammen bestimmen die Produktionsprozesse für das Medikament.
In der Entwicklungsphase liefert Inline-Analytik ein schnelleres und klareres Bild der Prozessdynamik als die herkömmliche Offline-Analytik. Zwar unterscheiden sich die Leistungsanforderungen bei der Entwicklung erheblich von denen im späteren Herstellungsprozess, aber durch die Anwendung der PAT-Werkzeuge in beiden Produktphasen werden die Prozessbesonderheiten besser ersichtlich und die Übertragung vom Labor auf die Großanlage einfacher.
PAT in der Prozessplanung
PAT ist auch ein integraler Bestandteil bei der Planung des Produktionsprozesses. Mit Hilfe von PAT werden robuste und durchdachte Prozesse entwickelt, wobei die definierten Parameter in Echtzeit überwacht und bei Bedarf korrigiert werden können. Während der Prozessplanung werden die erforderlichen Rohstoffmerkmale, Prozessparameter und qualitätsrelevanten Kennwerte für jeden Prozess ermittelt und Abhängigkeiten analysiert. Bei Produktionsaufnahme helfen Erfahrungen aus der Entwicklungsphase dabei, die Prozessentwicklung und Vermarktungszeit zu verkürzen. Wissen verändert sich - es wächst über den Lebenszyklus der Fertigung und PAT-Werkzeuge unterstützen Hersteller auf diesem Weg.
Real-Time Release Testing beschleunigt die Chargenfreigabe
Strenge Vorgaben und regelmäßige Qualitätschecks in der Pharmaindustrie führen oft zu kostspieligen Verzögerungen und unnötigem Materialverwurf. Über die Idee, Produktqualität mit Hilfe von Analysegeräten in Echtzeit zu messen, wird seit einem Jahrzehnt geredet, aber die Implementierung eines solchen Systems ist trotz überzeugender wirtschaftlicher Argumente noch relativ neu.
Real-Time Release Testing (RTRT) ist per definitionem die Fähigkeit, Produktqualität während des Herstellungsprozesses anhand von Echtzeit-Prozessdaten und nicht erst durch Endproduktprüfung zu gewährleisten. Für RTRT werden PAT-Systeme eingesetzt, die anhand von Analysegeräten und anderen Inlinemessungen Prozessdaten erfassen und daraus Qualitätsinformationen generieren, die zur Anpassung des Prozesses bei laufender Produktion verwendet werden können. RTRT ersetzt nicht die nach GMP erforderlichen Prüfungen und Qualitätssicherungsschritte für die Chargenfreigabe, aber das Verfahren kann die Endproduktprüfung ersetzen und damit den gesamten Herstellungsprozess rationalisieren. Ein Nebeneffekt ist, dass die integrierten Qualitätsinformationen automatisch in das Chargenprotokoll aufgenommen werden.
PAT in kontinuierlichen Prozessen
In der pharmazeutischen Produktion werden Chargengrößen häufig durch Produktionspläne, Kapazität oder bestimmte Kundenaufträge bestimmt. Während kontinuierliche Verarbeitung bekanntermaßen deutliche Vorteile gegenüber der Chargenproduktion hat, sind Hersteller gezwungen, aufgrund von Qualitätsrichtlinien in begrenzten Losgrößen zu denken. Hier setzt allerdings inzwischen - teilweise auch dank PAT - ein Umdenken ein.
Da PAT fortlaufend Qualitätsdaten in Echtzeit liefert, verwandelt die Technik einen Chargenprozess im Grunde in einen kontinuierlichen Prozess und ermöglicht konstante Qualitätsprüfungen, die eine Endproduktprüfung zur Chargenfreigabe unnötig machen. Anstatt endliche Mengen herzustellen können Hersteller den Material- und Produktfluss bedarfsgerecht steuern.
Quality by Design ist also ein Ansatz, der Flexibilität im Herstellungsprozess ermöglicht und mit dem dennoch ein konstantes Qualitätsniveau gehalten werden kann. PAT-Werkzeuge spielen eine Schlüsselrolle bei der Implementierung von QbD, weil sie Daten in Echtzeit zurückführen und somit bei Abweichungen eine Korrektur der kritischen Qualitätsparameter im laufenden Prozess ermöglichen. Außerdem werden Qualitätsdaten während des Prozesses erfasst, so dass Endproduktprüfungen nicht mehr erforderlich sind und somit die Chargenfreigabe enorm beschleunigt wird. Die zahlreichen wirtschaftlichen Vorteile von PAT-Werkzeugen sind außerordentlich attraktiv.
Teil 2 des Artikels " PAT kann Chargenprozesse kontinuierlich machen" lesen Sie hier
Kontakt
ARC Advisory Group GmbH & Co KG
Stadttor 1
40219 Düsseldorf
Deutschland
+49 2104 542 012