Validierung und Qualifizierung in den Life Science Industries
M+W will mit eValidation die Kosten im Griff halten
Hersteller und Zulieferer in regulierten Industriebranchen wie Pharma, Biotechnologie, Medizintechnik, Kosmetik und Lebensmittel stehen aus Gründen des Patienten- bzw. Verbraucherschutzes unter ständiger Kontrolle der Behörden hinsichtlich Einhaltung nationaler und internationaler Vorschriften.
Insbesondere die Good Manufacturing Practises (GMP) dienen zur Qualitätssicherung der Entwicklungs- und Produktionsprozesse. Diese Vorgaben verpflichten zu kostenintensiven Validierungs- und Qualifizierungsmaßnahmen von Anlagen, Räumlichkeiten, Verfahren und Ausrüstungsgegenstände einschließlich einer sehr detaillierten Dokumentation. Betroffen ist der gesamte Lebenszyklus einer Produktionsanlage von Entwicklung und Engineering über Installation und Betrieb bis zur Stilllegung.
Gleichzeitig stehen die Unternehmen unter wirtschaftlichem Druck nach Kostensenkung bei unveränderter Sicherheit und Qualität. Aus diesem Spannungsfeld heraus entstehen derzeit unter dem Begriff eValidation Lösungsansätze, die sich durch IT-gestützte Verfahren wie elektronische Freigaben, papierlose Archivierung oder Wiederverwendung von Vorlagen auszeichnen.
Compliance vs. Kostendruck
Die regulierten Unternehmen müssen den Behörden die Einhaltung aller Vorgaben (Compliance) durch eine vollständige Validierungs- und Qualifizierungsdokumentation in Entwicklung und Produktion nachweisen. Hierfür sind genaue Kenntnisse der Abläufe im GMP-Bereich eine wesentliche Voraussetzung: Nur so ist es möglich, ein System derart zu qualifizieren, dass es sowohl den Behördenanforderungen entspricht als auch für den Betreiber Produktionsvorteile und Kosteneinsparungen generiert. Besonders hohe Kosten entstehen bei verfahrenstechnischen Anlagen mit SPS oder Leitsystemen, bei Steril- und Reinigungssystemen sowie im EDV-Bereich (ERP, MES, LIMS).
Unsere über 15-jährige Projekterfahrung zeigt, dass in diesen Bereichen die Qualifizierung und Validierung fast ausschließlich noch in Papierform erfolgt. Erzeugung, Pflege, Aufbewahrung und Archivierung dieser Dokumentation macht einen nicht unerheblichen Teil der Entwicklungs- und Produktionskosten aus.
Mittlerweile sind jedoch Ansätze zur Kostensenkung zu erkennen:
• Die Behörden in Europa und USA akzeptieren zunehmend elektronische Werkzeuge z.B. für das Testmanagement ebenso wie den Einsatz der elektronischen Signatur.
• Industrieleitfäden wie GAMP 5 empfehlen „die Validierungsaufwendungen auf das Wesentliche zu beschränken" oder „durch ein integriertes Risikomanagement die wirklich kritischen Parameter von den unkritischen zu trennen".
• Auf Seiten der Unternehmen ist es vor allem das Bemühen um computergestützte Abläufe und papierloser Dokumentation, welches die Kosten reduzieren soll. Die Nachvollziehbarkeit bzw. Kontrolle sämtlicher IT-Aktivitäten tritt immer mehr in den Vordergrund.
• IT-Unternehmen bieten zunehmend Software und Dienstleistungen für eValidation an, die zumindest Teilbereiche des gesamten Prüf- und Dokumentationsprozesses abdecken.
Kluft zwischen Realität und Praxis
Die Möglichkeiten zur Kostenbegrenzung werden in der Praxis offensichtlich noch nicht nachhaltig umgesetzt. Das jedenfalls zeigen unsere Erfahrung bei Unterstützung von Unternehmen der Pharma- und Biotechbranche bei Planung und Engineering von Anlagen und speziell bei Validierungs- und Qualifizierungsprojekten:
• Unterschiedliche Fachabteilungen arbeiten an gleichen Dokumenten, aber mit unterschiedlichem Text- und Fachverständnis.
• Es fehlen Verbindungen und Bezüge zwischen den Dokumenten und der elektronischen Ablage und es fehlen organisatorische Standards für die einheitliche Ablage, Archivierung und Aktualisierung der Dokumente.
• Dokumentationsprüfung und Freigabezyklen sind außerordentlich personen- und zeitintensiv angelegt; trotzdem ist die Fehleranfälligkeit der Dokumente hoch.
• Gleichartige Testverfahren werden immer wieder neu konzipiert, dokumentiert und ausgeführt, vorhandene Dokumente selten wiederverwendet.
• Es treten Medienbrüche durch verschiedene und inkompatible Datenquellen auf.
• Das Änderungsmanagement an den Dokumenten wird unzureichend geplant und nur bedingt umgesetzt.
Diese Erfahrungen überraschen, denn mittlerweile liegt in den Unternehmen ein umfangreiches Know how über die Umsetzung kostensparender Prozesse vor. Dieses Wissen zusammen mit SOP (Standard Operation Procedure), Templates und vielen Best Practices Beispielen sollten eine ausreichende Basis zur Vermeidung oder zumindest Minderung der oben genannten Schwierigkeiten bieten.
Als eine Ursache sehen wir den stark projektbezogenen Einsatz von Mitarbeitern, der zu immer neu zusammengestellten Projektteams ohne Mitwirkung langjähriger Validierungs-Erfahrungsträger führt. Während in anderen Industriesektoren speziell ausgebildetes Fachpersonal diese Arbeiten begleitet, sind es im Life Science Sektor überwiegend technische und pharmazeutische Fachexperten, welche die Projektarbeit neben ihrem Tagesgeschäft unter Zeitdruck wahrnehmen müssen.
Eine Alternative zu speziell ausgebildetem Fachpersonal ist der Einsatz computergestützter Werkzeuge. Das gilt besonders für die arbeitsintensiven Bereich der „Verifizierung" im Rahmen von Testverfahren wie DQ, IQ, OQ und PQ.
Lösungsansatz eValidation
Mit unserem Ansatz einer eValidation-Lösung schlagen wir eine Erweiterung der bestehenden Teillösungen vor. Darunter verstehen wir den
• Einsatz moderner IT-Technologien zusammen mit Workflow-, Datenbank-, Text- und Dokument-Managementmethoden
• zur umfassenden und durchgängigen Unterstützung der Dokumentations- und Freigebeprozesse
• bei Planung, Spezifikation, Test, Validierung und Qualifizierung von Systemen der pharmazeutischen Industrie.
Wirtschaftliches Ziel ist die Einführung eines methodischen Wissensmanagements zur Nutzung vorhandener Informationen und Dokumentationen. Werkzeuge dazu sehen wir in modernen IT-Technologien, um damit die gegenwärtigen Beschränkungen durch manuelle Tätigkeiten und papiergebundene Dokumentation zu überwinden.
Leitlinien für die Erstellung sind eine enge Kooperation der verschiedenen Wissens- und Erfahrungsträger und konsequente Nutzung bereits vorhandener Ressourcen und Werkzeuge durch deren Integration. Die partnerschaftliche Zusammenarbeit von Unternehmen aus den Bereichen Produktion, Anlagenbau, Qualifizierungs- und Validierungsdienstleistung und IT-Lösungen kann das Zusammenführen und strukturierte Aufbereiten der jeweiligen Kenntnisse und Erfahrungen zu einem universellen, wiederverwendbaren Wissenspool ermöglichen.
Mit der Einbindung vorhandener und bewährter Methoden, Dokumente, Prozesse und computergestützter Tools in eValidation wird der intelligente Einsatz und die Verknüpfung einzelner bewährter IT-Technologien kombiniert mit dem Prozesswissen der involvierten Projektpartner ermöglicht. Deswegen propagieren wir den Einsatz und die Verknüpfung von modular aufgebauten Systemen mit ihren jeweiligen Stärken unter Einbeziehung der Anforderungen des Anwenders und einer Abbildung der pharmazeutischen Entwicklung- und Prozesswissens in den Systemen.
Damit sehen wir das Projekt als Evolution aus der heutigen Situation heraus mit dem Ziel, die Validierungs -und Qualifizierungskosten zu reduzieren sowie ein sicheres und verbessertes Dokumentenmanagement zu erreichen. Voraussetzung für die Umsetzung ist, dass sich Unternehmen der Pharma-Branche auf ein solches Projekt verständigen und einen Partner aus der IT-Branche zur Mitarbeit gewinnen können. Ein Dienstleister für Qualifizierung und Validierung könnte dazu eine Schnittstelle sein und seine einschlägigen Erfahrungen in eine solche Kooperation einbringen. Hilfreich wären auch Anstöße aus der Reihe der nationalen und internationalen Verbände oder Fachorganisationen (ICH, PIC, APV, VDI, ISPE, NAMUR, ACM etc.), um Standards und Verfahren für eValidation zu definieren.
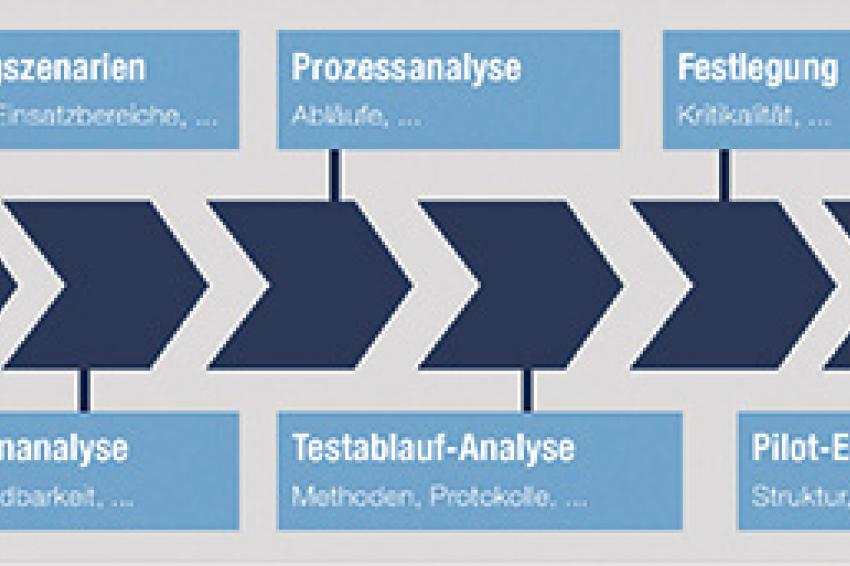
Anforderungen und Einsatzszenarien
Unsere Anforderungen an die eValidation-Lösung beruhen auf konsequenter Standardisierung und Strukturierung, nachhaltigem Wissensmanagement und Nutzung der neuen elektronischer Technologien. Elemente eines möglichen Lastenheftes sind:
• Strukturierte Erfassung der Anforderungen (Requirements Engineering)
• Strukturierte Erfassung der Spezifikationsdaten und Bibliotheksfunktionen mit Verweisen auf Normen, Empfehlungen und Richtlinien
• Unterstützung bei Durchführung und Dokumentation der Risikoanalysen (Failure Mode and Effects Analysis FMEA, Fault Tree Analysis FTA)
• Einsatz von elektronischer Werkzeuge für Test- und Abweichungsmanagement sowie Freigabeprozesse (Elektronisches Workflow Management, Elektronische Signatur)
• Verwendung von globalen und rollenbasierten Workflows zur Verfolgung von Abläufen und Dokumenten
• Einsatz hochstrukturierte Formulare mit intelligenten Templates und standardisierten Textbausteinen und deren Wiederverwendung (Textmanagement)
• Automatische Generierung von Spezifikations -und Testdokumenten aus einer Best Practice Bibliothek (bei neuen Projekten)
• Einfaches Handhabung und transparente Mensch-Maschine Schnittstelle
Fazit
Das Umfeld für eine nachhaltige Kostensenkung bei Validierung und Qualifizierung von Pharma-Prozessen und -Anlagen durch eValidation ist erfolgversprechend. Praktische Erfahrungen und umfangreiche Prozesskenntnisse sind bei den Unternehmen vorhanden, neue IT-Technologien stehen zu Verfügung. Dadurch wäre z.B. eine Entwicklung in Analogie zur erfolgreichen Einführung und Etablierung von ERP- und MES-Systemen möglich.
Hierzu kann M+W Process Industries eine „Schnittstelle" für die Zusammenarbeit zwischen Produzenten, Anlagenbauern und IT-Dienstleistern bieten. Wir unterstützen die Industrie seit langem bei Planung, Einführung und Validierung von entsprechenden Teillösungen durch Definition der Anforderungen, Marktanalysen, Lieferantenauswahl bis hin zur Projektdurchführung.
Kontakt
M+W Process Industries
Lotterbergstr. 30
70499 Stuttgart
Deutschland
+49 711 8804-1800
+49 711 8804-1888