E-Pedigree-Richtlinie: Hohe Anforderungen an Organisation und Prozesse
Branchenweite Umsetzungsstandards empfehlenswert
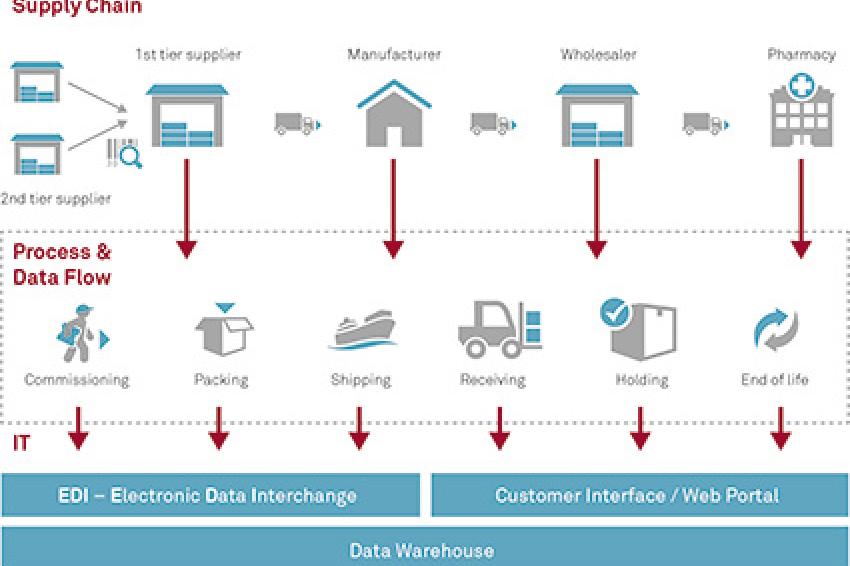
2016 tritt in der EU die E-Pedigree-Richtlinie in Kraft. Dann müssen verschreibungspflichtige Medikamente mit einer eindeutigen Identifikationsnummer gekennzeichnet, Inhaltsstoffe und Herstellung lückenlos dokumentiert sein - die Serialisierung des elektronischen Stammbaums (E-Pedigree) ist dann Pflicht. CHEManager sprach mit Stephan Willigens, Vice President Supply Chain Management von MSG Systems, über die Herausforderungen und Chancen von E-Pedigree für Pharmaunternehmen und ihre Zulieferer.
CHEManager: Was bedeutet E-Pedigree für die Pharmaunternehmen?
Stephan Willigens: E-Pedigree stellt Pharmaunternehmen (OEM) und Zulieferer vor hohe Anforderungen an Organisation und Prozesse: Sie müssen Milliarden von Seriennummern generieren und für die korrekte Kennzeichnung und Dokumentation von Herstellung und Produkten sorgen. Das bedeutet: Umrüstung von Maschinen und IT, zusätzliche Prozessschritte und mehr Aufwand bei Herstellung und Verpackung. Je mehr Lieferanten und Produktionsstätten verbunden sind, desto komplexer ist die Umsetzung. Zudem verfolgen momentan viele Hersteller eigene Lösungen. Empfehlenswert wäre, sich auf einen branchenweiten Standard mit gemeinsamen Lösungen zur Warennachverfolgung zu verständigen und die Lieferanten, insbesondere die Contract Manufacturing Organizations (CMO), tiefer in den Informationsfluss zu integrieren.
Welche Bereiche in den Unternehmen sind betroffen?
Stephan Willigens: Die Umsetzung von E-Pedigree und Serialisierung ist primär ein Organisationsprojekt, doch sie wirkt sich auf fast alle Unternehmensbereiche aus: Direkt betroffen sind alle Abteilungen, die mit Beschaffung, Wertschöpfung/Produktion, Lagerung und Logistik befasst sind, wie z.B. Engineering, Einkauf, Produktion, QA/QC und IT. Indirekt betroffen sind Vertrieb, Marketing, R&D und die Rechtsabteilung. Letztere beispielsweise muss gemeinsam mit dem Einkauf die Nachverfolgbarkeit in die Verträge mit Kunden und Lieferanten einbinden. Die IT ist eine weitere Schlüsselstelle für die Umsetzung.
Wo muss die Anpassung der Prozesse beginnen?
Stephan Willigens: Am besten am Anfang der Wertschöpfungskette - aufgrund der geforderten lückenlosen Dokumentation und weil die Umstellung auf E-Pedigree auch die Chance bietet, die Organisation und die Prozesse weiter zu optimieren, bis hin zur Implementierung einer integrierten Supply Chain. Die Basis für die Umstellung bildet ein Anforderungskatalog, erst dann werden Maschinen beschafft, Systeme für Tracking & Tracing und Serialisierungslösungen implementiert oder Interfaces aufgesetzt.
Wer im Unternehmen muss bei der Umstellung eingebunden werden?
Stephan Willigens: Alle betroffenen Bereiche sollten eingebunden sein. Definitiv notwendig sind ein Sponsor aus Geschäftsführung oder Vorstand sowie Vertreter der Bereiche Finanzen, Einkauf, Engineering, Produktion, QA/QC, Supply Chain Management, Logistik, IT und Vertrieb.
Wie lassen sich Dienstleister und Lieferanten einbinden?
Stephan Willigens: Dienstleister und Lieferanten spielen eine wichtige Rolle bei der Datenübermittlung, -dokumentation und -qualitätssicherung: Sie müssen die Qualität und Vollständigkeit ihrer Produkte kontinuierlich monitoren und die Informationen darüber sowie über ihre Vorlieferanten weitergeben.
Damit die Dokumentation und Informationsweitergabe weitestgehend standardisiert erfolgen kann, sollten die OEM die CMO, Lieferanten und Dienstleister frühzeitig aktiv einbinden - schließlich werden deren Informationen verarbeitet. Unter anderem ist zu klären, in welcher Form und aus welchen Systemen Informationen vorliegen, welche Voraussetzungen für die Verarbeitung erforderlich sind - und welche Anforderungen andere OEM definieren.
Wie lange dauert die Umstellung etwa?
Stephan Willigens: Wie viel Zeit nötig ist, hängt von der Komplexität und Tiefe der Integration von Dienstleistern und Prozessen ab. Grob geschätzt kann man für die Umstellung rund 18 Monate veranschlagen. Dabei sollte vor der Umsetzung eine detaillierte Analysephase stehen, damit die Potentiale, Synergien und Risiken identifiziert und während der Umsetzung adressiert werden können. Nicht zuletzt im Zusammenspiel der Anforderungen aus E-Pedigree und Serialisierung.
Mit welchem Kostenaufwand ist bei der Umstellung zu rechnen?
Stephan Willigens: Der Aufwand lässt sich nicht so einfach pauschal beziffern - schließlich ist jedes Unternehmen anders organisiert und verfügt über eine andere Wertschöpfungskette. Die reinen Umstellungskosten dürften sich wohl nach rd. 18 Monaten amortisieren, sofern Serialisierung und E-Pedigree gemeinsam implementiert werden. Wenn sich ein branchenweiter Standard, beispielsweise nach GS1, etabliert, geht es schneller, wenn nicht, dauert es länger. Zusammenfassend lässt sich sagen: Die Umsetzung der E-Pedigree-Richtlinie bedeutet für Pharmaunternehmen und Zulieferer einen hohen organisatorischen und finanziellen Aufwand. Sie bietet aber auch die Chance, Organisation und Prozesse unternehmensübergreifend in Richtung einer integrierten Supply Chain weiterzuentwickeln."
Kontakt
msg systems ag