Pall: Prozesschromatographie & Optimierungspotentiale
Der Bedarf an leistungsstarken, effizienten und wirtschaftlichen Techniken im biopharmazeutischen Umfeld wächst
Die in den vergangenen Jahren erzielten Leistungssteigerungen im Upstream-Bereich von biotechnologischen Produktionsprozessen erfordern nun eine nachhaltige Optimierung der folgenden Aufreinigungsprozesse im Downstream-Bereich. Insbesondere im Hinblick auf die chromatographischen Aufreinigungsmethoden ist ein Bedarf für leistungsstärkere Techniken entstanden, die die traditionellen Verfahren der Ionenaustauschchromatographie, der Affinitätschromatographie oder der Hydrophoben Interaktionschromatographie ergänzen.
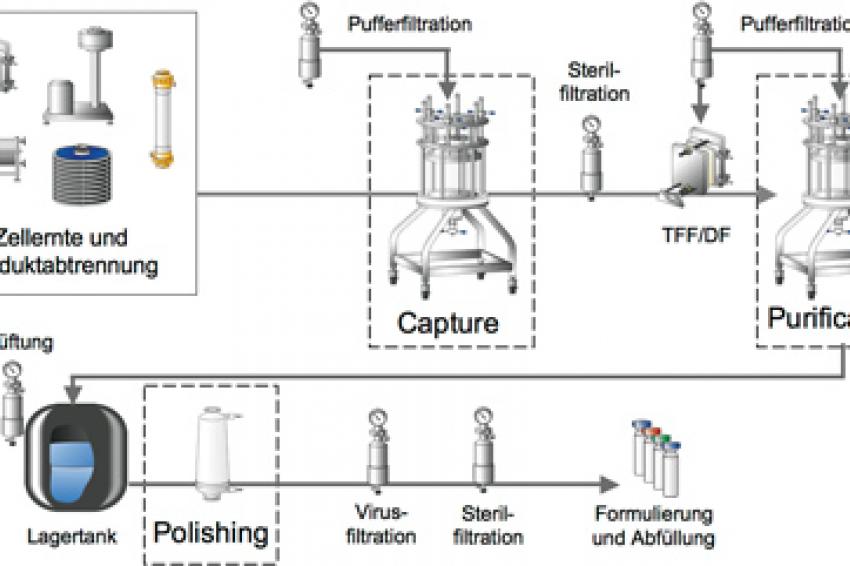
Nachdem die Anzahl biotechnologisch hergestellter Arzneimittel weiter steigt, rücken die Schwachstellen der konventionellen Techniken zunehmend in den Vordergrund. Welche Alternativen oder Weiterentwicklungen gibt es? Die Aufreinigung therapeutischer Proteine im Downstream Processing umfasst in der Regel eine Serie aufeinander folgender chromatographischer Arbeitsschritte, die sich grob in die Teilbereiche Capture, (Intermediate) Purification und Polishing aufteilen lassen (Abb. 1). Der initiale Capture Schritt verfolgt primär die Aufkonzentrierung des Zielproteins durch Abtrennung von Wasser als „Hauptverunreinigung". Darüber hinaus soll das Zielprotein in eine stabilisierende, proteasefreie Umgebung überführt werden. Somit ist neben einer hohen dynamischen Bindungskapazität des chromatographischen Mediums die Geschwindigkeit von großer Bedeutung. Der intermediäre Purification Schritt dient der eigentlichen Aufreinigung, so dass an dieser Stelle eine ausgezeichnete Auflösung selbst strukturell ähnlicher Verbindungen (z.B. Aggregate, Missfaltungen) gewährleistet sein sollte. Der abschließende Polishing Schritt sorgt schließlich für den finalen Feinschliff, d.h. die Entfernung verbliebener Spurenverunreinigungen (DNA, Endotoxine, Viren, Wirtszellproteine). Das Zielprotein muss am Ende des Aufreinigungsprozesses in maximaler Ausbeute und höchster Reinheit vorliegen.
Status Quo in der Prozesschromatographie
Als chromatographische Aufreinigungstechniken haben sich insbesondere die Ionenaustauschchromatographie (IEX), die Affinitätschromatographie (AC) und die Hydrophobe Interaktionschromatographie (HIC) etabliert. Sie bieten wichtige Leistungsvorteile, lassen aber dennoch Spielraum für Verbesserungen. Ihre bekannten Schwachstellen mögen bislang mehr oder weniger bereitwillig akzeptiert worden sein, doch erzwingen die stark gestiegenen Proteinausgangskonzentration (im Bereich von 10 g/l) und Zellkulturvolumina (im Bereich von 20.000 l) ein Umdenken. Außer diesen prozesstechnischen Überlegungen spielen wirtschaftliche Faktoren eine entscheidende Rolle. Der Anteil der Chromatographie an den Gesamtkosten biotechnologischer Prozesse (Upstream & Downstream) hat infolge der upstream-seitigen Fortschritte erheblich zugenommen. In den meisten Prozessen stellt ein Anteil von 40-60% eine realistische Größenordnung dar, so dass die Chromatographie neben der ebenfalls kostenintensiven Virusfiltration den größten finanziellen Aufwand erfordert. Die Entwicklung neuer Prozesse, die effizient und wirtschaftlich zugleich ausgelegt sein sollten, ist folglich eine der ganz großen Herausforderungen.
Optimierungsmöglichkeiten
Die aufgeführten chromatographischen Aufreinigungsverfahren bieten viele wertvolle Handhabungsvorteile. Andererseits besteht eine Reihe kritischer Schwachstellen, deren Überwindung neue Perspektiven in der Prozessentwicklung und -führung eröffnen könnte:
- Verzicht auf drastische pH-Werte zum Erhalt der biologischen Integrität der Zielproteine
- Begrenzung der erforderlichen Feedstock-Verdünnung vor dem initialen Protein Capture
- Auflösung von Proteinen mit ähnlichen Eigenschaften (Hydrophobizität & pI)
- Senkung der Konzentration kritischer Salze (z. B. Ammoniumsulfat)
- Vereinfachung der Regeneration (Kompatibilität mit 1 N NaOH)
- Minimierung der Anzahl an Umpufferungsschritten
- Senkung der Aufreinigungskosten
Diese Auflistung, die keinen Anspruch auf Vollständigkeit erhebt, darf als Wunschliste der biopharmazeutischen Industrie angesehen werden. Sie spricht alle bereits erwähnten Spielarten der Prozesschromatographie an.
Ionenaustauschchromatographie IEX
Die IEX erfordert die sorgfältige Einstellung des Feedstocks hinsichtlich pH-Wert und Leitfähigkeit, so dass dieser nicht immer direkt aus dem Bioreaktor übernommen werden kann. Die Bindungskapazität würde in diesem Falle mit wenigen mg/ml sehr gering ausfallen. In der Regel wird der pH-Wert im Bereich zwischen pH 3 und 5 eingestellt. Die Leitfähigkeit, die häufig zunächst bei 15 - 19 mS/cm liegt, wird üblicherweise auf 5 - 7 mS/cm gesenkt. In der Praxis bedeutet dies oftmals eine Verdünnung des Feedstocks (Faktor 3 - 6). Mag dies im Labormaßstab akzeptabel sein, stellen Zellkulturvolumina von mehr als 10.000 l völlig andere Anforderungen. Alleine die erforderlichen Puffermengen brächten erhebliche Probleme hinsichtlich Kosten und Lagerung. Idealerweise sollte somit eine nur minimale (oder gar keine) Verdünnung erforderlich und dennoch eine hohe Kapazität und hohe Wiederfindung der Wertstoffe gewährleistet sein.
Die IEX kommt besonders dann an ihre Grenzen, wenn Proteine mit ähnlichen isoelektrischen Punkten voneinander zu trennen sind. So wird es i. d. R. nicht gelingen, unerwünschte Aggregate ohne einen zusätzlichen Chromatographieschritt sicher und vollständig zu entfernen.
Affinitätschromatographie AC
Die AC, die in ihrer kostenintensiven Protein A Variante zur Aufreinigung monoklonaler Antikörper sehr gebräuchlich ist, erfordert die Einstellung sehr saurer Elutionsbedingungen (pH < 3). Als Folge ergibt sich die Gefahr unerwünschter Aggregatbildung oder Denaturierung der Zielproteine. Hinzu kommt ein signifikantes Auswaschen der Liganden mit zunehmender Säulenlebensdauer, so dass sich Protein A in der Zielfraktion wieder findet und später in einem Folgeschritt entfernt werden muss.
Protein A-Sorbentien sind darüber hinaus nicht vollständig mit 1 N NaOH kompatibel, so dass zur Regeneration in der Regel mildere Bedingungen erforderlich sind. Diese ermöglichen eine akzeptable Lebensdauer des Sorbens, erhöhen andererseits aber das Risiko unerwünschter Kreuzkontaminationen.
Hydrophobe Interaktionschromatographie HIC
Die HIC verlangt die anfängliche Zugabe großer Mengen anti-chaotroper Salze. Diese sorgen für eine Hydrophobisierung der Probe und sind eine wesentliche Voraussetzung für deren Retention durch die ebenfalls hydrophoben HIC-Liganden (z.B. Octyl). Anwendung findet oftmals Ammoniumsulfat in hohen Konzentrationen (bis 3 M). Im industriellen Maßstab mit Volumina von mehreren 1.000 l bedeuten diese massiven Salzmengen einen Alptraum. Sie verursachen Säulenhardwareprobleme durch Korrosion und müssen später wieder aus der Zielfraktion entfernt werden. Somit entsteht zusätzlicher Arbeitsaufwand, der weitere Kosten für das Recycling der ökologisch problematischen Ammoniumverbindungen nach sich zieht. Vor allem diese Zusatzkosten sind einer der großen Kritikpunkte.
Alle aufgeführten Aspekte verdeutlichen das Optimierungspotential der derzeit für die Prozesschromatographie gebräuchlichen Methoden. An genau dieser Stelle liegt das große Potential der Mixed-Mode Chromatographie.
Mixed-Mode Sorbentien (Capture und Purification)
Der Begriff Mixed-Mode bezeichnet einen multiplen Retentionsmechanismus als Grundlage der Wechselwirkungen zwischen der Probe und dem Sorbens. Schon in den 70er Jahren experimentierten findige Forscher mit ausgefallenen Mixed-Mode Liganden, doch lagen im Prozessmaßstab kommerziell verfügbare Sorbentien damals noch in weiter Ferne. Mittlerweile hat sich das Bild verändert. Mixed-Mode Sorbentien haben massiven Zugang in die Prozessentwicklung für neue chromatographische Verfahren gefunden. Ein Beispiel ist die in den industriellen Maßstab skalierbare HyperCel Mixed-Mode Plattform zur Proteinaufreinigung. Sie umfasst die drei synthetischen Sorbentien MEP HyperCel, HEA HyperCel und PPA HyperCel, deren Liganden auf einer robusten Matrix verankert sind (Abb. 2). In der Praxis werden die Sorbentien bereits in Säulen mit einem Volumen von mehreren 100 l eingesetzt. Tab. 1 fasst wichtige chemisch-physikalische Eigenschaften der Hypercel Mixed-Mode Sorbentien zusammen.