Serialisierung: Pharmaindustrie in der Pflicht
Bosch Packaging präsentiert mehrstufiges Maschinen- und Softwarekonzept
Für die Serialisierung von Pharmaverpackungen ist 2015 ein wichtiges Stichjahr. Zahlreiche Gesetze und Richtlinien für die Rückverfolgbarkeit von Arzneimitteln treten weltweit in Kraft. Medikamentenhersteller stehen vor der Herausforderung, geeignete Technologien zu finden, zu implementieren und mit ihren Herstellungs- und Verpackungsprozessen optimal zu verknüpfen. Ein mehrstufiges Maschinen- und Softwarekonzept stellt dabei zweifellos den sichersten Ansatz dar.
Nachdem Barack Obama im November 2013 seine Unterschrift unter den „Drug Quality and Security Act" setzte, kam Bewegung in die pharmazeutische Industrie. Das Gesetz verleiht der amerikanische FDA (Food and Drug Administration) mehr Autorität, um das seit Langem geplante System für die Integrität pharmazeutischer Lieferketten umzusetzen. So strebt die FDA eine standardisierte Kennzeichnung (standardized numerical identifier, SNI) in Form eines 2D Data Matrix Codes auf Verpackungsebene für alle verschreibungspflichtigen Arzneimittel an. Voraussichtlich soll der SNI-Code bis Ende November 2017 implementiert werden. Für die gesamte Umsetzung des Gesetzes - inklusive landesweiter, öffentlicher Datenbanken - ist insgesamt eine Zeitspanne von zehn Jahren, also bis 2023/24 vorgesehen.
Parallel sind viele weitere Staaten mit der Entwicklung und Umsetzung neuer Richtlinien und Gesetze befasst, darunter Brasilien, China und Argentinien. Die brasilianische Behörde für Gesundheitsüberwachung ANVISA beispielsweise veröffentlichte Ende 2013 eine Resolution, deren Umsetzung bereits bis Dezember 2016 erfolgen soll. Das türkische Serialisierungsprogramm (ITS) ordnet sogar die Serialisierung aller frei verkäuflichen und verschreibungspflichtigen Medikamente auf Stückbasis von der Produktion bis hin zum Patienten per 2D Data Matrix Code an.
EU-Richtlinie mit zusätzlicher Sicherheitsebene
Die Richtlinie 2011/62/EU (Falsified Medicines Directive) der Europäischen Union wurde 2011 erlassen. Sie sieht die Einführung kodierter Verpackungen mit eindeutiger Seriennummer für nahezu alle verschreibungspflichtigen Arzneimittel vor. Als Sicherheitsmerkmal wird - wie in vielen anderen Staaten - eine 2D Data Matrix verwendet. Diese enthält den Code des Arzneimittelherstellers, eine randomisierte Serialisierungsnummer, die Chargennummer und das Verfallsdatum sowie gegebenenfalls eine nationale Nummer für die Kostenerstattung. Voraussichtlich bereits ab 2018 sollen die verschreibungspflichtigen und einige OTC (over-the-counter, nichtverschreibungspflichtige) Arzneimittel den 2D Data Matrix Code für die Verifizierung in der Apotheke tragen.
Gleichzeitig verlangt die EU nach einer zweiten Sicherheitsebene in Form von manipulationssicheren Verschlüssen, wie zum Beispiel ein Unversehrtheitssiegel oder eine Leimung. Sie zeigen auf, ob eine Verpackung schon einmal geöffnet oder anderweitig manipuliert wurde. Während einige Länder wie Italien und Belgien bereits heute Vignetten auf den Außenverpackungen vorschreiben und Frankreich sogar schon einen 2D Data Matrix Code verlangt, ist das Hauptbestreben der Richtlinie 2011/62/EU eine EU-weite Harmonisierung der Gesetzgebung und der verwendeten Codes beziehungsweise Siegel.
Automobilindustrie als Vorbild
Die kommenden Jahre stellen die Pharmabranche vor enorme Herausforderungen. Produzierende Unternehmen müssen die jeweiligen Richtlinien innerhalb des vorgegebenen Zeitrahmens umsetzen. Und diese Umsetzung wird nicht leicht: Die meisten Konzerne kommen nicht umhin, erst eine globale Strategie für die durchgängige Vergabe von Seriennummern zu entwickeln und zu implementieren. Dafür gilt es, die richtigen, mit den hauseigenen Prozessen kompatiblen Lösungen zu finden, was eine Anpassung oft höchst anspruchsvoller Verpackungsprozesse zur Folge hat. Des Weiteren müssen neue Abläufe für die Verwaltung und Speicherung der Seriennummern etabliert werden.
Im Automobilbereich sind Track & Trace-Systeme bereits seit vielen Jahren erfolgreich im Einsatz, insbesondere für die Rückverfolgbarkeit sicherheitsrelevanter Teile wie Bremsen und Steuerkomponenten. Dieses Know-how hat sich Bosch Packaging Technology zunutze gemacht und es auf den Pharmabereich übertragen. Die zugrunde liegende Anforderung lässt sich gut mit einem Stichwort beschreiben: „modular". Denn ein Track & Trace-System sollte nicht nur in der Lage sein, das verpackte Produkt massenweise zu serialisieren, das heißt jede Packung mit einem Code zu bedrucken. Die Codes müssen eindeutig verifizierbar sein. Ferner erhalten die Verpackungen in der Regel noch ein Etikett oder Unversehrtheitssiegel, ehe sie der Umverpackung zugeführt werden. Der gesamte Prozess sollte einheitlich steuerbar und die Daten jederzeit abrufbar sein. Denn nur so haben die Hersteller - und nachher Ausgabestellen sowie Gesetzgeber - alle Schritte des Prozesses exakt im Blick.
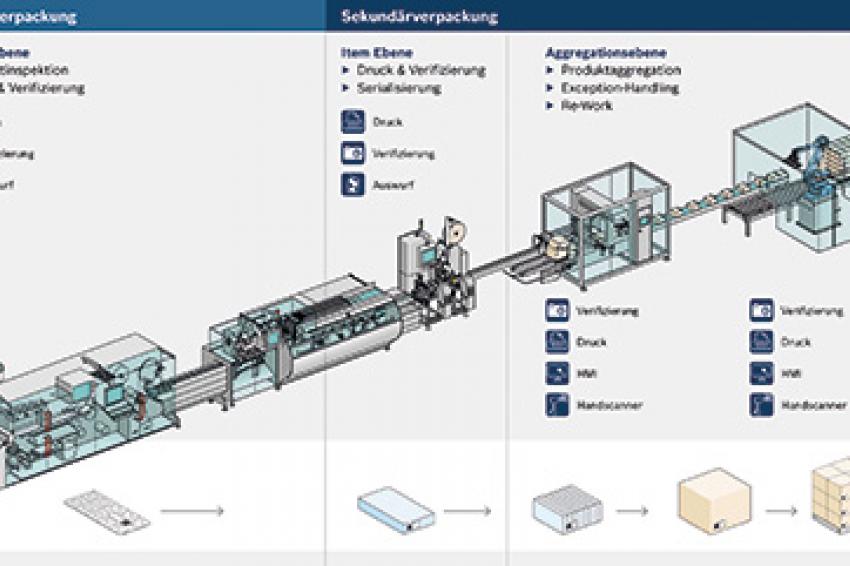
Von der Applikations- bis zur Unternehmensebene
Serialisierung und Aggregation stellen sehr hohe Anforderungen an die IT. Verpackungsprozesse müssen mit den neu integrierten Abläufen synchronisiert werden; parallel findet die Entwicklung gänzlich neuer Prozesse für die konsequente und sichere Verwaltung und Speicherung der Seriennummern statt. Die Einbindung der Verpackungsmaschinen in die neuen Abläufe ist ein elementarer Bestandteil eines modernen Serialisierungsprojektes. Sie erfordert eine sorgfältige Planung, um die Seriennummern eindeutig und dauerhaft auf dem gewünschten Integrationslevel - von der Applikationsebene über den Linienprozess und die Linienverwaltung bis hin zur Produktions- und Unternehmensebene - speichern zu können.
Auf der Applikationsebene befinden sich die einzelnen Komponenten wie Drucker und Kameras. Über eine zentrale Bedienerschnittstelle lassen sich die Module steuern und die Daten dokumentieren. Damit sowohl Betriebszustände als auch Daten jederzeit kontrollierbar sind, muss die Vernetzung zwischen dem physischen Maschinenlevel und der Steuerungssoftware mehrstufig in die Unternehmens-IT integriert werden. Dabei kann beispielsweise das MES (Manufacturing Execution System) als Übersetzungsplattform zwischen der Maschine und dem ERP-System (Enterprise Resource Planning) dienen und die gesamte Produktionsumgebung abbilden.
Das Track & Trace-System sollte prinzipiell in der Lage sein, Informationen in Echtzeit auszuwerten und folgende Fragen zu beantworten: Wo befindet sich welches Produkt? Welche Informationen sind für dieses Produkt verfügbar? Dazu gehören beispielsweise Informationen über den Inhalt des Codes, den aktuellen Gesamtstatus der Aggregation und Produktion sowie Qualitätsdaten wie etwaige Fehlerbilder und Gewichte. Alle diese Ergebnisse werden an übergeordnete ERP-Systeme auf Unternehmensebene gemeldet.
Umsetzung leicht gemacht
Wie Bosch Packaging Technology das Track & Trace-Prinzip aus der Automobilindustrie auf pharmazeutische Anwendungen übertragen und ausgebaut hat, zeigt zum Beispiel das CPS 1900 (Carton Printing System) mit Tamper Evident-Etikettierer. Das modulare System bedruckt bis zu 300 Faltschachteln pro Minute und appliziert zusätzlich Sicherheitssiegel, um die Verpackungen und ihren Inhalt vor Manipulation zu schützen. Zu diesem Zweck lassen sich beide Seitenlaschen der Faltschachtel wahlweise von unten oder oben versiegeln und das Siegel auf Anwesenheit prüfen. Nach dem Aufdruck der Tracking-Daten auf die Verpackung erfolgt eine automatische Verifizierung über das Kamerasystem, das jedes einzelne aufgedruckte Zeichen erfasst.
Mit einer zentralen Bedieneinheit ausgestattet, wird das CPS zu einem Gesamtsystem, das alle Produktions-, Druck- und Layoutdaten zentral verwaltet und konfiguriert. Anhand einer generischen, objektorientierten und ereignisbasierten Software-Plattform lässt sich das System um alle notwendigen Aggregationsstufen wie Bündel, Versandkartons oder Paletten erweitern. Auch nachträgliche Umrüstungen bestehender Verpackungslinien sind möglich.