Pharmazeutische Lieferketten auf dem Prüfstand
Geopolitische Herausforderungen erhöhen Druck auf Politik und Unternehmen
Der Ausbruch der Covid-19-Pandemie brachte industrielle Lieferketten durcheinander und die Globalisierung zum Stillstand. Geopolitische Herausforderungen erhöhen nicht nur aufgrund von Rohstoffabhängigkeiten den Druck auf Politik und Unternehmen. So sind u.a. die angespannten Beziehungen zwischen den USA und China, die mit der Ukraine-Krise einen neuen Tiefpunkt erreicht haben, Zeichen einer geopolitischen Zeitenwende, welche stark fragmentierte globalisierte Wertschöpfungs- und Lieferketten vor neue Aufgaben stellen.
Unter diesen Vorzeichen nahmen Forderungen nach Rückverlagerungen von Produktionen deutlich an Fahrt auf – vor allem mit Blick auf systemrelevante Güter wie Arzneimittel. Hier werden sowohl in der breiten Öffentlichkeit als auch in Fachkreisen hohe Abhängigkeiten von Wirkstofflieferungen aus dem asiatischen Raum, vornehmlich aus China, als Argument für einen politischen Handlungsbedarf herangezogen. Doch es braucht einen differenzierten Blick auf pharmazeutische Lieferketten und Abhängigkeiten entlang der Wertschöpfungskette, um zielgerichtet Maßnahmen zur Stärkung des pharmazeutischen Forschungs- und Produktionsstandorts sowie zur Sicherung der Arzneimittelversorgung der Bevölkerung ableiten zu können.
Übersehen wird häufig, dass es nicht „die eine“ pharmazeutische Lieferkette gibt. Die pharmazeutische Industrie in Deutschland ist vor allem auf die Produktion hochwertiger und komplexer Wirkstoffe und Arzneimittel spezialisiert. Doch in der Versorgung stellen Generika, d.h. wirkstoffgleiche Nachahmerpräparate, mit einem Anteil von fast 80 % an den täglich benötigten Arzneimitteldosen den überwiegenden Teil der in Deutschland abgegebenen verschreibungspflichtigen Arzneimittel – diese werden überwiegend im nichteuropäischen Ausland produziert. Abhängigkeiten entlang der Wertschöpfungskette sind im generischen und innovativen Bereich folglich unterschiedlich zu bewerten. Darüber hinaus gibt es weitere Abhängigkeiten entlang der Lieferketten, die berücksichtigt werden müssen.
Grundstoff-, Arzneimittelproduktion und Verpackung: Unterschiede in der regionalen Konzentration
Pharmazeutische Unternehmen verteilten in den letzten Jahrzehnten ihre Forschungs- und Produktionsstandorte weltweit, um bspw. regionale Wettbewerbsvorteile zu nutzen oder ihre Logistik zu optimieren und Kosten zu senken. Das betraf vor allem die primäre Wirkstoffproduktion gerade im generischen Bereich, so dass diese geografisch oftmals von der sich anschließenden Sekundärproduktion (Formulierung, Abfüllung bzw. Tablettierung, Endverpackung) getrennt sind.
Zudem zeigt sich, dass die Zahl der sekundären Fertigungsstandorte, welche lokale oder regionale Märkte beliefern, die Zahl der Standorte der primären Herstellung deutlich übersteigt. Hieraus ergeben sich signifikante Unterschiede in der regionalen Konzentration der Fertigungsstandorte entlang der pharmazeutischen Wertschöpfungskette, vor allem mit Blick auf die Bedeutung Asiens für die Pharmaproduktion.
„Häufig wird übersehen, dass es nicht „die eine“ pharmazeutische Lieferkette gibt.“
Die Analyse der bei der US-amerikanischen Food and Drug Administration (FDA) registrierten Produktionsstandorte für Fertigarzneimittel, Wirkstoffe und Verpackung zeigt für den US-Pharmamarkt, dass die Produktion für Fertigarzneimittel im Gegensatz zur Wirkstoffproduktion wesentlich häufiger in den USA erfolgt. 22 % der Produktionsstandorte für Wirkstoffe sind in den USA angesiedelt, aber 64 % der Produktionsstandorte für Fertigarzneimittel, die den US-Markt versorgen. Auf der Stufe der Verpackung sind es 46 % der Standorte. Eine analoge Auswertung für den europäischen Markt ist aufgrund der eingeschränkten Datenlage nicht möglich. Laut Branchenvertretern ist allerdings von vergleichbaren Tendenzen für den europäischen Markt auszugehen.
Hilfsstoffe, Verpackungsmaterialien und Produktionstechnik: die unterschätze Abhängigkeit
In Deutschland ansässige Pharmaunternehmen beziehen Vorprodukte wie Startmaterialien und Hilfsstoffe ebenso wie Verpackungsmaterialien sowohl aus dem Inland als auch aus dem Ausland. Dabei berichten eine Reihe von Unternehmen, dass im Verlauf der Coronapandemie die Verfügbarkeit von benötigten Materialien wie Packmittel aus Glas und der Bezug kritischer Hilfsstoffe oftmals eine größere Herausforderung darstellten als der Bezug der für die Arzneimittelproduktion benötigten Wirkstoffe.
Doch gerade die in der Wirkstoffproduktion langen Bestandsreichweiten von 210 bis 300 Tagen verhindern, dass Störungen der Wirkstoffproduktion direkt in Versorgungseinschränkungen resultieren. Entsprechend führten die durch die Coronapandemie bedingten Produktionsunterbrechungen in der asiatischen Wirkstoffherstellung, insbesondere in China, im März und April 2020 nicht zu den anfänglich befürchteten Versorgungsengpässen. Wären in China hingegen in größerem Maße die Fertigarzneimittelproduktion sowie die Verpackung ansässig, wären die Werksschließungen deutlich schwieriger zu kompensieren gewesen. So liegt bspw. die Bestandsreichweite auf der Stufe der Verpackung bei 75 bis 115 Tagen. Hinzu kommt, dass die Top-10-Produktkategorien bei den Vorleistungen mit den höchsten Anteilen von Zulieferungen aus China und Indien Wirkstoffe, Hilfsstoffe und Verpackungsmaterialien umfassen.
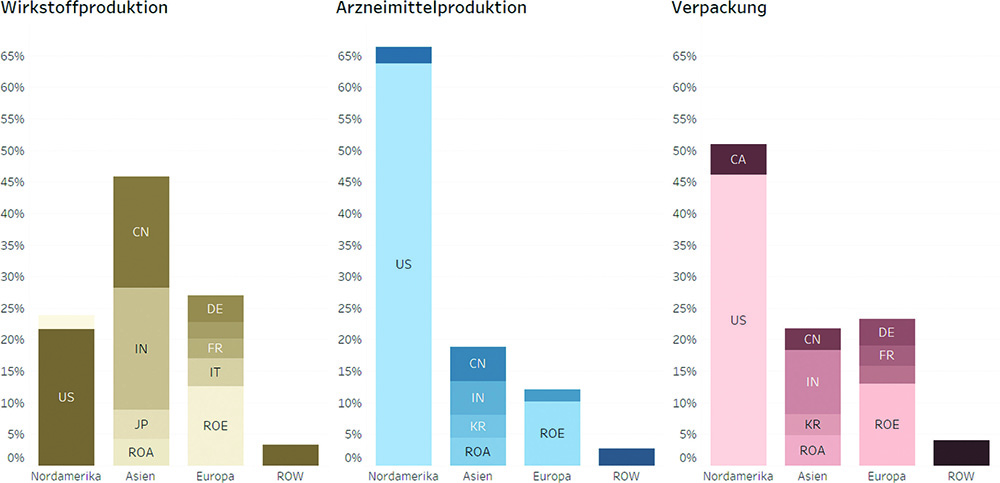
Grafik 1: In den nachgelagerten Produktionsstufen nimmt die Bedeutung Asiens als Produktionsstandort ab.
Anmerkung: Datenbasis ist die Zahl der Produktionsstandorte von für die USA bestimmten Wirkstoffen und Arzneimitteln, Stand:24.02.2020. Anteile werden auf Basis der Kombination Standort und durchgeführte Produktionsschritte (Wirkstoffproduktion, Arzneimittelproduktion, Verpackung) berechnet. Quellen: FDA, www.fda.gov
Biopharmazeutika: Europa und die USA haben (noch) die Nase vorn
Zwischen den Arzneimittelsegmenten unterscheidet sich die regionale Herkunft der Wirkstoffe deutlich. Während die für generische Arzneimittel verwendeten, chemisch erzeugten Wirkstoffe vorwiegend in Asien, hier vor allem in China und Indien, hergestellt werden, zeigt die regionale Verteilung der Produktionsstandorte von in der Europäischen Union zugelassenen biopharmazeutischen Wirkstoffen ein anderes Bild (Grafik 2). Biopharmazeutische Produktionsstätten befinden sich überwiegend in Europa (54 %) und in den USA (32 %). Mit einem Anteil von 12 % entfallen auf Deutschland nach den USA die meisten zugelassenen Produktionsstätten für Biopharmazeutika. Asien hält mit 14 % einen vergleichsweise geringen Anteil der Standorte.
„Gesetzte Rahmenbedingungen müssen langfristig für Unternehmen planbar sein.“
Deutlich wird: Deutschland ist, ebenso wie die USA, auf die Produktion innovativer und technisch komplexer Arzneimittel und ihrer Wirkstoffe spezialisiert, was u. a. den ökonomischen Rahmenbedingungen geschuldet ist. Doch mit Blick auf biopharmazeutische Produktionskapazitäten fällt Deutschland im internationalen Vergleich mittlerweile zurück. Lag Deutschland im Jahr 2018 noch auf dem dritten Platz der größten biopharmazeutischen Produktionsstandorte, gemessen an der national zur Verfügung stehenden Fermenterkapazität, lag es 2021 auf Platz fünf.
Weit vorne liegen die USA vor Südkorea. China rückt mit Investitionsoffensiven in ihre biopharmazeutischen Produktionskapazitäten näher (Platz neun). Auch bei den Zulassungen von Produktionsstandorten für Biopharmazeutika gewinnen China und Indien an Bedeutung: War vor 2013 keine Produktionsstätte in China oder Indien gemeldet, wurden von der Europäischen Arzneimittelagentur (EMA) seitdem zehn Biopharmazeutika mit Fertigung in diesen beiden Ländern zugelassen – alle im Bereich der Biosimilars.
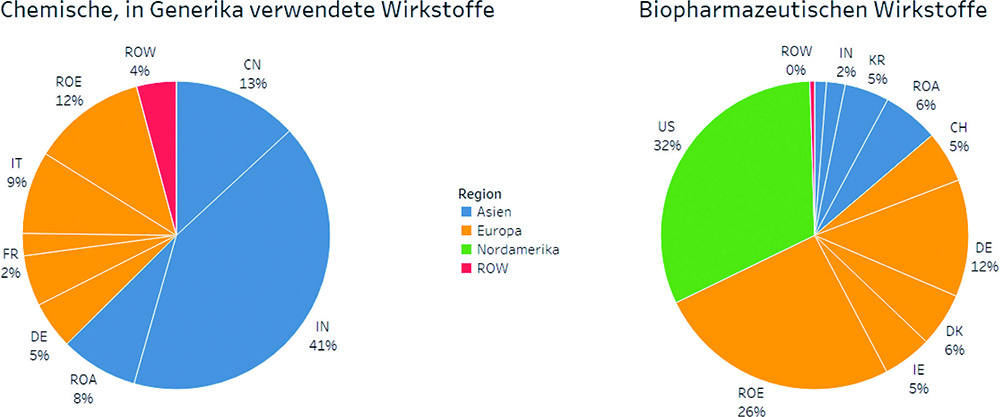
Grafik 2: Biopharmazeutische Wirkstoffe werden primär in Europa und in den USA hergestellt.
Anmerkung linke Seite: Berechnungsbasis für die Anteile ist die Zahl der zertifizierten Zulassungen (CEPs: „Certificate of Suitability of Monographs of the European Pharmacopoeia“) in den Ländern. Quelle: Progenerika (2020), eigene Berechnungen.
Anmerkung rechte Seite: Originalprodukte und Biosimilars abzüglich nicht mehr zugelassener Arzneimittel. Gezählt werden Wirkstoffe pro Standort. Zahlen zeigen kumulierte Zulassungen ab 2000.
Quelle: European public assessment reports (EPARs) der EMA, https:/www.ema.europa.eu, eigene Berechnungen
Stärkung des Pharmastandorts als Gebot der Stunde
Potenzielle Maßnahmen zur Stärkung des Pharmastandorts dürfen nicht singulär auf generische Wirkstoffproduktionen ausgerichtet sein, sondern müssen zum einen alle Arzneimittelmittelsegmente und zum anderen die gesamte pharmazeutische Wertschöpfungskette in den Blick nehmen. Insbesondere bei den biopharmazeutischen Wirkstoffen wird befürchtet, dass sich die in den letzten Jahrzehnten bei den Generika beobachtete Entwicklung wiederholen könnte und es mittelfristig zu einer Abwanderung biopharmazeutischer Produktionen in Richtung Asien kommt. Wenn pharmazeutische Lieferketten langfristig gestärkt werden sollen, darf nicht nur über Rückverlagerungen aus Asien gesprochen werden, sondern es muss auch sichergestellt sein, dass die bestehenden (bio-)pharmazeutischen Produktionen langfristig am Standort Deutschland gehalten werden. Gerade dies ist auch eine wichtige Maßnahme zum langfristigen Erhalt des Industriestandorts Deutschland. Benötigt werden hier industriepolitische Rahmenbedingungen, welche die Attraktivität des Pharmastandorts im globalen Standortwettbewerb für Forschung und Produktion steigern. Dabei gilt: Gesetzte Rahmenbedingungen müssen langfristig für Unternehmen planbar sein und nicht kurzfristig je nach Kassenlage im Gesundheitssystem erratisch zurückgenommen werden.
Autoren:
David Francas, Prof., Hochschule Heilbronn, und Leiter Healthcare Supply Chain Institute, Heilbronn
Jasmina Kirchhoff, Projektleiterin für Pharmastandort Deutschland, Institut der deutschen Wirtschaft Köln e.V., Köln
--------------------------------------------------------------------------------------------------------------------------------------------------------
Der Artikel greift Ergebnisse aus der Studie „Resilienz pharmazeutischer Lieferketten“ auf (u.a. kostenlos verfügbar auf www.vfa.de). Weitere verwendete Quellen können bei den Autoren angefragt werden.
-----------------------------------------------------------------------------------------------------------------------------------------------------------
Zur Person
David Francas ist Professor für Logistik und Informationssysteme an der Hochschule Heilbronn und wissenschaftlicher Leiter des Healthcare Supply Chain Institute. Zuvor arbeitete Francas als Management-Berater und Projektleiter für eine internationale Beratungsgruppe. Er promovierte mit Auszeichnung an der Universität Mannheim im Bereich Logistik und Management Science. Er ist Autor zahlreicher Bücher und Fachartikel und leitete mehrere, teils internationale, Forschungs- und Beratungsprojekte. In seiner Karriere hat er erfolgreich sowohl mit führenden Unternehmen aus der Gesundheitsbranche wie AstraZeneca, Boehringer Ingelheim, Bristol Myers Squibb, Novartis, Roche als auch mit Marktführern aus anderen Branchen wie BASF zusammengearbeitet.
Zur Person
Jasmina Kirchhoff hat nach einem Studium der Volkswirtschaftslehre an der Universität Bielefeld dort ihre Promotion zu Nationalen Innovationssystemen in Transformationsländern abgelegt. Sie hatte einen Forschungsaufenthalt am Centre for Innovation, Research and Competence in the Learning Economy (CIRCLE) der Universität Lund, Schweden. Seit 2009 ist sie am Institut der deutschen Wirtschaft im Kompetenzfeld Öffentliche Finanzen, Soziale Sicherung, Verteilung. Bis Januar 2021 war sie hier als Senior Economist an der Forschungsstelle Pharmastandort Deutschland und Gesundheitswirtschaft tätig und seit Februar 2021 ist sie dort Projektleiterin.














