Serialisierung von Pharmaverpackungen
Skalierbares Maschinen- und Softwarekonzept für Falsified Medicines Directive
Ob Potenzmittel oder lebenserhaltende Pharmazeutika – der Handel mit gefälschten Medikamenten boomt nach wie vor. Entsprechend rückt die Serialisierung von Pharmaverpackungen immer stärker in den Fokus pharmazeutischer Produzenten und Lohnverpacker. Die Zeit drängt, da zahlreiche Gesetze und Richtlinien in den kommenden Jahren weltweit in Kraft treten oder bereits umgesetzt sein müssen.
Im Februar 2016 trat die Richtlinie 2011/62/EU (Falsified Medicines Directive) der Europäischen Union in Kraft. Innerhalb von drei Jahren sieht sie die Einführung kodierter Verpackungen mit eindeutiger Seriennummer für alle verschreibungspflichtigen Arzneimittel vor. Als Sicherheitsmerkmal wird – wie in vielen anderen Staaten – ein 2D Data Matrix Code verwendet. Dieser enthält eine randomisierte Serialisierungsnummer, die Chargennummer, das Verfallsdatum sowie weitere Daten nach Bedarf. Gleichzeitig verlangt die EU nach einer zusätzlichen Sicherheitsebene in Form von manipulationssicheren Verschlüssen, wie zum Beispiel ein Unversehrtheitssiegel oder eine Leimung, die in der CEN-Norm DIN EN 16679:2015-03 festgehalten sind. Sie zeigen auf, ob eine Verpackung schon geöffnet oder anderweitig manipuliert wurde.
Die betroffenen Unternehmen stehen vor der Herausforderung, geeignete Technologien zu finden, zu implementieren und mit ihren Herstellungs- und Verpackungsprozessen optimal zu verknüpfen. Ein skalierbares Maschinen- und Softwarekonzept stellt dabei zweifellos den sichersten Ansatz dar.
Hin zur vollständigen Vernetzung
In den USA wurde bereits am 27. November 2013 der „Drug Quality and Security Act“ (DQSA) verabschiedet. Anfang 2015 begann die Umsetzung auf Chargenebene, ab 2017 steht die Serialisierung von Primärverpackungen an. Die größere Herausforderung besteht für alle Beteiligten allerdings ab 2019: Dann muss im Pharma-Großhandel die Seriennummer jeder Einzelpackung als auch von Umverpackungen bekannt sein – entweder in Form des National Drug Code (NDC) oder der Global Trade Identification Number (GTIN). Zuerst sind alle Medikamentenhersteller in der Pflicht. Im Abstand eines Jahres folgen dann jeweils die Umverpacker, Großhändler und Ausgabestellen. Genau zehn Jahre nach Inkrafttreten des DQSA, also Ende November 2023, soll die vollständige Vernetzung und Aggregation umgesetzt sein. Anhand der eindeutigen Seriennummer lassen sich Produkte dann auf sämtlichen Aggregationsebenen sowie auf Chargen- und Einzelverpackungsebene elektronisch entlang der gesamten Lieferkette bis hin zur Ausgabestelle eindeutig und in Echtzeit rückverfolgen.
Parallel sind viele weitere Staaten mit der Entwicklung und Umsetzung neuer Richtlinien und Gesetze befasst. In der MENA-Region (Mittlerer Osten und Nordafrika) etwa sind die Bemühungen um Medikamentenrückverfolgbarkeit bereits angelaufen. Saudi-Arabien hat beispielsweise im März 2015 mit obligatorischen Data Matrix Codes auf den Verpackungen die erste Phase eingeläutet. 2017 wird Phase 2 – die eigentliche Serialisierung – in Kraft treten. Während Phase 1 lediglich eine Maschine für die Bedruckung von Data Matrix Codes erfordert, benötigen Hersteller und Verpacker in Phase 2 eine serialisierungsfähige Maschine sowie eine IT-Infrastruktur, um die Seriennummern zu erstellen. Sie müssen ferner in der Lage sein, die Nummern an Maschinen zu schicken und die Ergebnisse an entsprechende Herstellerdatenbanken zurückzumelden und zu speichern.
Signifikante Unterschiede
Worin bestehen nun die fundamentalen Unterschiede zwischen den unterschiedlichen Umsetzungsstadien? Auf der einen Seite misst die EU dem Thema Manipulationssicherheit eine besonders hohe Bedeutung bei. Andererseits setzen die USA sehr früh auf die erste Aggregationsstufe und verändern damit nicht nur die Bedingungen für dort ansässige Pharmaunternehmen, sondern auch für Importeure. Wird das Thema Serialisierung aktuell häufig noch als regionale Verantwortung verstanden, so wirken die verschiedenen Gesetzgebungen sich doch global aus: Viele große Medikamentenhersteller betreiben Produktionsstandorte in den unterschiedlichsten Ländern und exportieren ihre Produkte in die ganze Welt. Verpackungslinien gemäß einem einzigen Standard auszustatten, wäre hier zu kurzsichtig.
Ein Beispiel aus der Praxis: Ein großer Generikahersteller aus der MENA-Region vertreibt seine Produkte sowohl im heimischen Markt als auch in Europa und den USA. Verpackt wird der Großteil der Pharmazeutika direkt an den Produktionsstandorten in Jordanien und Saudi-Arabien. Vor diesem internationalen Hintergrund müssen sämtliche pharmazeutischen Verpackungen unterschiedliche nationale Serialisierungsstandards erfüllen. Entsprechend groß ist auch der Bedarf nach flexiblen Lösungen, die weit mehr als eine nationale Richtlinie erfüllen. Gleiches gilt für Lohnverpacker, die sich nach den Gesetzen des jeweiligen Marktes und den Anforderungen ihrer Auftraggeber richten müssen.
Verpackungsprozesse anpassen
Generell werden die meisten produzierenden und verpackenden Unternehmen nicht umhin kommen, eine globale Strategie für die durchgängige Vergabe von Seriennummern zu entwickeln und zu implementieren. Dafür gilt es, die richtigen, mit den hauseigenen Prozessen kompatiblen Lösungen zu finden, was eine Anpassung oft höchst anspruchsvoller Verpackungsprozesse zur Folge hat. Des Weiteren müssen neue Abläufe für die Verwaltung und Speicherung der Seriennummern etabliert werden. Die zugrunde liegende Anforderung lässt sich gut mit einem Stichwort beschreiben: „modular“. Denn eine vollumfängliche Serialisierungslösung sollte nicht nur in der Lage sein, das verpackte Produkt massenweise zu serialisieren, die Codes zu verifizieren und mit Etiketten oder Unversehrtheitssiegeln zu versehen. Darüber hinaus sollte der gesamte Prozess einheitlich steuerbar und die Daten jederzeit abrufbar sein. Denn nur so haben die Hersteller – und nachher Ausgabestellen – alle Schritte des Prozesses exakt im Blick.
Zu diesem Zweck hat Bosch Packaging Technology die CPI-Software für Track & Trace entwickelt, die sich leicht in bestehende IT-Infrastrukturen integrieren lässt. Dabei schöpft das Unternehmen aus der hauseigenen Erfahrung des Kraftfahrzeugbereichs, wo Automatisierung sowie Vernetzung von Maschinen, Prozessen und IT jahrelang erprobt sind. Logik und Funktionalitäten wurden auf den konkreten pharmazeutischen Bedarf bei Track & Trace-Anwendungen übertragen und angepasst.
Von der Maschine bis in die Datenbank
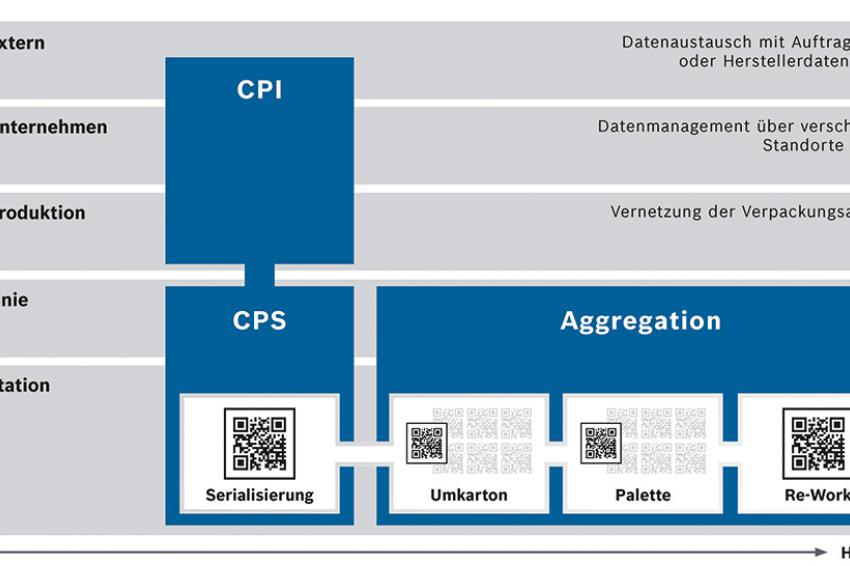
Wie kann man sich einen ganzheitlichen Serialisierungsprozess in der Realität vorstellen? Er beginnt auf der Applikationsebene (Level 1). Hier serialisiert das modulare CPS-System von Bosch bis zu 400 Faltschachteln pro Minute. Das Kamerasystem verifiziert automatisch die aufgedruckten Tracking-Daten. Im Anschluss appliziert der Tamper-Evident Etikettierer zusätzlich ein Sicherheitssiegel. Über eine zentrale Bedienerschnittstelle lassen sich die Module steuern und die Daten dokumentieren (Level 2).
Damit sowohl Betriebszustände als auch Daten jederzeit kontrollierbar sind, muss die Vernetzung zwischen dem physischen Maschinenlevel und der Liniensoftware mehrstufig in die Unternehmens-IT integriert werden (Level 3). Ab diesem Level kommt die CPI-Lösung für Track & Trace zum Einsatz, die dafür sorgt, dass die gesamte Produktionsumgebung oder mehrere Standorte abgebildet werden (Level 4). Darüber hinaus besteht die Möglichkeit einer Schnittstelle, etwa zur SecurPharm Datenbank oder zum Auftraggeber, über die der Datentransfer erfolgt (Level 5).
Weltweit und flexibel
Zurück zum Beispiel des Generikaherstellers: Dieser hat seine Verpackungslinien mit CPS-Modulen und CPI-Software ausstatten lassen. Ganz besonders profitiert das Unternehmen von der neuen Datenverbindung zwischen sämtlichen, über verschiedene Standorte verteilten Linien, die nun vom Hauptsitz aus einsehbar sind. Somit stehen alle relevanten Daten im gesamten Firmennetzwerk zur Verfügung; sämtliche Ereignisse werden im Audit-Trail protokolliert. Die Datensätze werden gemäß den Vorgaben zur Aggregation zusammen mit den Produktionsergebnissen gebündelt an die CPI-Software zurückgesendet – und lassen sich von dort aus an die behördlichen oder herstellereigenen Datenbanken übertragen.
Je nach Land und Richtlinie werden die Seriennummern entweder landesweit zentral vergeben oder vom Unternehmen selbst generiert. Lohnhersteller wiederum beziehen die Nummern auch von ihren Auftraggebern. Hier ist ebenfalls höchste Flexibilität in den Prozessabläufen gefragt. Die CPI-Lösung von Bosch ist für alle drei Fälle gerüstet. Damit lässt sich nicht nur die Serialisierung von der Vergabe der Seriennummer bis hin zur letzten Aggregationsstufe managen. Auch einzelne Komponenten und Fremdmaschinen, Verpackungslinien, eigene oder fremde IT-Systeme und ganze Fabriken können flexibel miteinander vernetzt werden, ganz wie es die jeweiligen Richtlinien einfordern. Entsprechend lohnt sich der Blick über den Tellerrand – sowohl für Hersteller und Lohnverpacker als auch für Maschinenbauer, die ihre internationalen Kunden im Fokus haben.