Regulatory Affairs – was es ist und wozu es dient
Die Aufgaben der Zulassungsabteilung in der chemisch-pharmazeutischen Industrie
Die Zulassung von Bioziden, Pflanzenschutzmitteln und Pharmazeutika in Europa ist sehr komplex und für Einsteiger oftmals verwirrend. So hat die European Medicines Agency (EMA) auf ihrer Website ca. 1.000 Richtlinien, Konzeptpapiere, Hinweis-, Fragen- und Antwortdokumente veröffentlicht, welche regelmäßig aktualisiert werden. Die europäische Chemikalien-Zulassungsbehörde ECHA, pflegt sogar über 5.000 solcher Dokumente. Die Zahlen verdeutlichen, dass in der chemisch-pharmazeutischen Industrie grundlegendes Know-how nötig ist, um den Dschungel von Gesetzen und Richtlinien zu durchdringen.
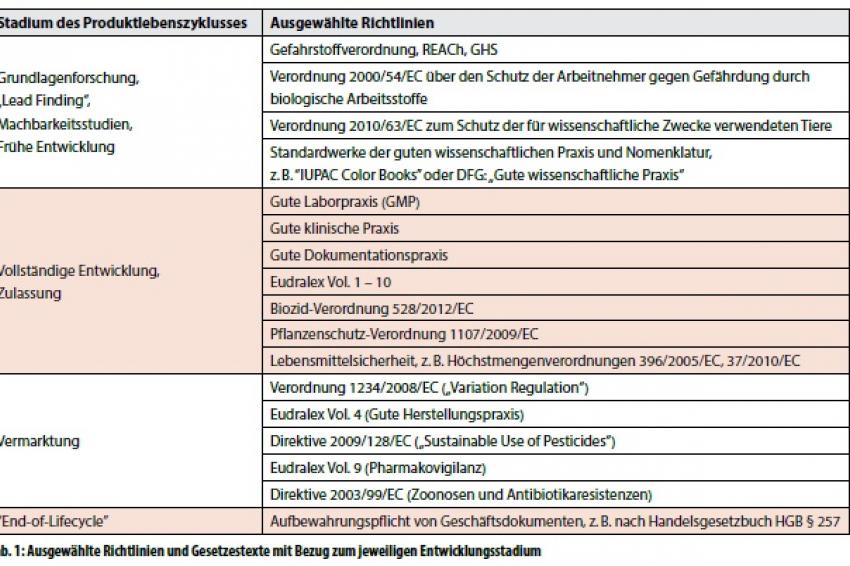
Generell wird zur Zulassung von chemischen und pharmazeutischen Produkten deren Sicherheit und Wirksamkeit evaluiert. Die Evaluierung erstreckt sich über den gesamten Lebenszyklus des Produkts, d.h. Forschung und Entwicklung, Produktion, als auch Vertrieb, Anwendung und Eintrag in die Umwelt werden betrachtet. Tabelle 1 zeigt eine Auswahl an Gesetzen und Verordnungen auf nationaler und EU-Ebene, welche in der täglichen Praxis eine Rolle spielen. Diese bestimmen ab der frühen Entwicklungsphase bis über das Ende der Produktvermarktung hinaus die Anforderungen an eine Regulatory-Affairs-Abteilung.
Kernaufgaben einer Zulassungsabteilung
Die Kernaufgabe der Abteilung ist es, die Daten aus verschiedensten Fachabteilungen aufzubereiten, diese bei der Interpretation der Daten zu unterstützen, deren Vollständigkeit gemäß dem Anforderungsprofil der Zulassungsbehörden zu überprüfen und zu guter Letzt alle Studienberichte, Risikoanalysen, Expertenberichte und Zusammenfassungen in geeigneter Form, dem sog. Dossier, den Behörden zu übermitteln. Besondere „Highlights“ im Alltag eines Regulatory Managers sind natürlich Ersteinreichungen von neu entwickelten Produkten oder neuen Technologien, weil eben diese meist mehrere spannende wissenschaftliche Herausforderungen enthalten, zu deren Lösung man beigetragen hat. Sind im Rahmen des Neuzulassungsverfahrens alle Fragen geklärt, erteilt die zuständige Behörde die Zulassung und das Produkt darf vermarktet, d.h. „in Verkehr gebracht“ werden. Nun ist es aber so, dass es mit einer einmaligen Einreichung selten getan ist: Im Laufe der Produktion ergeben sich Änderungen, sei es, dass z.B. die Chargengröße angepasst werden muss, oder sich neue wissenschaftliche Erkenntnisse ergeben haben, die es notwendig machen, die gemeldeten Daten zu überprüfen und ggf. zu ändern. Solche typischen „Life-Cycle-Management“-Aufgaben bedeuten für die Regulatory-Affairs-Abteilung, dass Änderungsanzeigen erstellt werden müssen. Dabei werden die neuen Daten mit den Fachabteilungen diskutiert, konsolidiert, auf Vollständigkeit abgeklopft und schließlich den Behörden zur Begutachtung vorgelegt. Manche dieser Änderungsanzeigen sind ausdrücklich genehmigungspflichtig, manche nur meldepflichtig. Die Herausforderung besteht darin, mehrere z.T. voneinander unabhängige Änderungen aus Produktion über Analytik, Marketing und Vertriebskette so zu managen, dass Kunden stets mit dem Produkt beliefert werden können und nicht etwa die Belieferung kurzzeitig eingestellt werden muss, weil eine Genehmigung seitens der Behörden (noch) nicht vorliegt. Angesichts einer globalen Vermarktung, jedoch unterschiedlichster nationaler Anforderungen und Begutachtungszeiträumen, können diese Aktivitäten schätzungsweise ca. 60-80% der Grundlast einer Zulassungsabteilung betragen.
Grundlegende Elemente der Zulassungsverfahren
Trotz aller Unterschiede in der Anwendung von Bioziden, Pflanzenschutzmitteln, Veterinär- und Humanpharmazeutika, steht sowohl für Produzenten wie Behörden der Schutz von Mensch, Tier und Umwelt an erster Stelle. So nimmt es nicht Wunder, dass alle Gesetzeswerke ähnliche Grundelemente enthalten:
- Produkte und deren Wirkstoffe sind genehmigungspflichtig: Der Hersteller muss die Wirksamkeit und Sicherheit des Produkts nachweisen, bevor es vermarktet werden kann.
- Änderungen des Dossiers sind möglich und bedürfen der Meldung oder der Genehmigung seitens der Behörden.
- Wiederzulassungsverfahren werden meist nach einem Zeitraum von ca. fünf bis zehn Jahren notwendig. Hierbei werden die bei der Erstzulassung eingereichten Daten mit den Erkenntnissen aus der Praxis verglichen und zugelassene Anwendungen ggf. geändert oder sogar eingeschränkt.
- Unerwartete wissenschaftliche Ergebnisse, z.B. bis dato unbekannte schwere Nebenwirkungen für Mensch, Tier oder Umwelt oder Resistenzprobleme sind in jedem Fall meldepflichtig.
- Die Zulassungsverfahren sind eingebettet in weitere Regelwerke zur Überwachung des Markts, wie z.B. die sog. Pharmakovigilanz, die Konformität der Herstellung nach GMP, oder die Überwachung der Produktionsanlagen nach den gängigen Gesundheits-, Sicherheits- und Umweltschutzvorschriften.
- Es existieren Regelungen für erleichterte Zulassungsverfahren, bspw. für Produkte mit bereits erwiesener Wirksamkeit und Sicherheit (Generika), Nischenanwendungen („Minor Use“) oder Produkte mit sehr niedrigem Risiko.
- Um einen funktionierenden Markt zu gewährleisten, gibt es Regelungen zur Vertraulichkeit von Geschäftsdaten.
- Wenn der Antragssteller nicht mit Bescheiden der Behörden zufrieden ist, regeln Einspruchsverfahren die weitere Vorgehensweise.
Strategische Fragestellungen werden zunehmend wichtiger
Angesichts der geschilderten Komplexität sind Zulassungsprozesse und Zulassungsanforderungen daher nicht nur entscheidend für die Verbrauchersicherheit, sondern haben auch starken Einfluss auf die Innovationsaktivitäten der chemischen und pharmazeutischen Industrie. Nach dem Fünf-Kräfte-Modell von Michael E. Porter wirken die folgenden Kräfte auf ein Unternehmen ein:
- Konkurrenz zwischen den bestehenden Wettbewerbern
- Bedrohung durch neue Anbieter
- Verhandlungsstärke der Lieferanten
- Verhandlungsstärke der Abnehmer
- Bedrohung durch Ersatzprodukte
Für Unternehmen der Chemie- und Pharmabrache ist es nur logisch, eine sechste Kraft hinzuzufügen: das regulatorische Umfeld. Die Regulatory-Affairs-Abteilung muss daher nicht nur in anspruchsvolle wissenschaftliche Themen eintauchen und operativ glänzen können – sie sollte sich auch mit allen anderen Abteilungen eines Unternehmens, von der Rechts- und Patentabteilung über Produktion, Compliance, Vertrieb und Marketing bis hin zur Geschäftsleitung vernetzen, um einen strategischen Beitrag zum Erfolg des Unternehmens zu leisten.
Kontakt
GDCh Gesellschaft Deutscher Chemiker e.V.
Varrentrappstraße 40-42
60486 Frankfurt am Main
Deutschland
+49 69 7917 485
+49 69 7917 475