Sinnvolle Revolution oder Prozess mit Bremseffekt?
Seit Mitte 2022 ist die EU-Verordnung über die Bewertung von Gesundheitstechnologien (HTA) in Kraft.
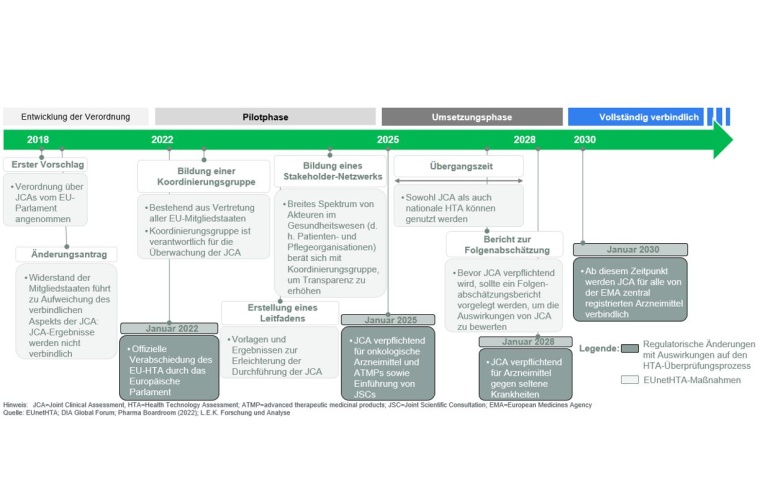
Sie soll den Zugang zu Medikamenten und medizinischen Innovationen in Europa revolutionieren. Ab 2025 gibt es erste verpflichtende Konsequenzen. Was bedeutet die Verordnung konkret für die Pharmaindustrie und was sind die Vor- und Nachteile?
Die EU-Verordnung über Health Technology Assessments (HTA), also die Bewertung von Gesundheitstechnologien, führt zu bedeutenden Veränderungen für die Pharmaindustrie in Europa. Ab 2025 werden gemeinsame klinische Bewertungen, sog. Joint Clinical Assessments (JCAs), für Krebstechnologien verpflichtend. Ab 2028 gilt dies ebenfalls für Produkte gegen seltene Krankheiten und ab 2030 für alle Gesundheitstechnologien. Eine Regelung, die möglicherweise einen schnelleren Markteintritt für Pharmaprodukte in allen EU-Mitgliedstaaten verspricht. Insbesondere Länder, die bisher in späteren Wellen bei der Produkteinführung berücksichtigt wurden, könnten nun früher Zugang zu innovativen medizinischen Therapien erhalten. Das gilt bspw. für osteuropäische Staaten.
Durch die Verordnung besteht für Pharmaunternehmen und Behörden die Hoffnung, dass Doppelarbeit reduziert wird, was wertvolle Ressourcen und Zeit spart. Operativ gesehen dürfte sich diese Bündelung der Behördenressourcen jedoch auf die europäische Ebene beschränken, ohne dass sie zu einer Verringerung des Aufwands auf nationaler Ebene führt, denn: nationale HTA-Stellen werden nicht ersetzt und können weiterhin zusätzliche Daten anfordern. Auch die bereichsübergreifende Zusammenarbeit zwischen klinischen, kommerziellen und regulatorischen Einrichtungen wird verstärkt gefordert sein. Pharmaunternehmen befürchten, dass bewährte Bewertungs- und Zulassungsprozesse wie in Deutschland durch weniger flüssig laufende Verfahren in anderen Ländern ausgebremst werden. Es besteht jedoch auch die Chance, dass funktionierende Prozesse übertragen werden und alle Beteiligten profitieren.
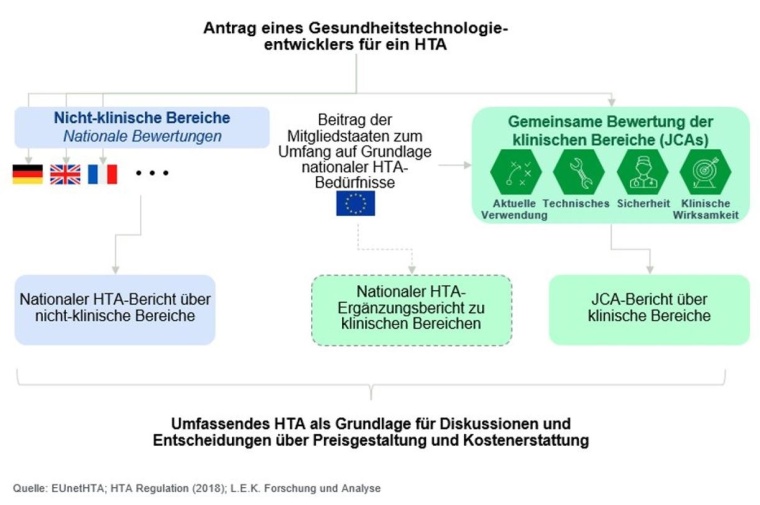
Das Fachwissen zu zentralisieren verspricht präzisere und qualitativ hochwertigere Beurteilungen. Ein weiterer Pluspunkt ist, dass die Vorgehensweise deutlich vorhersehbarer und einheitlicher ist und damit eine nahtlose Übertragbarkeit der Ergebnisse in ganz Europa ermöglicht. Eine Herausforderung ist jedoch die Harmonisierung verschiedener Ansätze einzelner Mitgliedsstaaten, denn die Anforderungen sind von Land zu Land unterschiedlich. Dies soll über den PICO-Prozess erfolgen, was für Population, Intervention, Comparator, Outcomes steht und ein Hilfsschema der evidenzbasierten Medizin zur Formulierung einer recherchierbaren Fragestellung ist. Verzögerungen im Joint-Clinical-Assessment (JCA)-Prozess könnten den Prozess verlangsamen und den Patientenzugang zu Medikamenten verzögern.
„Das Fachwissen zu zentralisieren verspricht präzisere
und qualitativ hochwertigere Beurteilungen.“
Die Bedeutung der gemeinsamen Bewertungen innerhalb der anstehenden nationalen Beurteilungen kann variieren. Das liegt zum einen an dem unverbindlichen Aspekt der Verordnung und zum anderen an dem Spielraum, den die nationalen HTA-Stellen bei der Ergänzung der Ergebnisse der gemeinsamen Bewertungen haben. Außerdem ist zu erwarten, dass die JCAs keine eindeutige positive oder negative Empfehlung aussprechen werden, was zu einer gewissen Unsicherheit für die nationalen HTA-Stellen führt. Entscheidend für den künftigen Erfolg der JCAs wird es sein, die operativen Aspekte zu klären und die HTA-Methoden zu vereinheitlichen. Das Engagement der nationalen HTA-Gremien und ihre Fähigkeit, eine gemeinsame Basis zu finden, spielen dabei eine zentrale Rolle.
Eine weitere Ungewissheit ergibt sich, wenn die Märkte unterschiedliche lokale klinische Praktiken aufweisen. Sie haben andere Standpunkte, wenn es darum geht, das entsprechende Nutzenpotenzial zu bewerten. Das erfordert eine Lösung im Rahmen der PICO-Prozesse.
Fazit
Trotz bestehender Herausforderungen bietet die EU-HTA-Verordnung langfristig Vorteile wie größere Effizienz und Transparenz. Pharmaunternehmen haben bereits jetzt die Möglichkeit, freiwillig JCAs zu beantragen, um sich mit dem Prozess vertraut zu machen und die genannten Vorteile zu nutzen. Die Bereitschaft der Unternehmen, sich diesen neuen Gegebenheiten anzupassen, wird darüber entscheiden, wie erfolgreich diese Reise sein wird.
Verena Ahnert, Partnerin, L.E.K. Consulting, London













