Monitoringsysteme für natürliche Produkte
21.07.2011 -
Zukunftsorientiert wie erfahren, modern und traditionell anthroposophisch - das ist die Weleda AG. Die Firma begann im Jahre 1921 als pharmazeutischer Laborbetrieb mit eigenem Heilpflanzengarten. Heute ist das Unternehmen der weltweit führende Hersteller von Arzneimitteln der Komplementärmedizin (anthroposophische Therapie) und ganzheitlicher Naturkosmetik. Ziel und Aufgabe des Unternehmens: die Gesundheit des Menschen zu erhalten, zu fördern und wiederherzustellen.
Das Weleda Leitmotiv gilt seit der Gründung des Unternehmens. Dabei handelt es sich um einen ganzheitlichen Ansatz, der sich auf alle Tätigkeitsbereiche auswirkt. In den Arbeitsabläufen des Unternehmens drückt sich dieses Leitmotiv in einem respektvollen Umgang mit der Natur und einem offensiven Umweltschutz aus. Die Produkte stehen nicht nur für umweltverträgliche Rohstoffe, sondern auch für einen sparsamen Umgang mit den natürlichen Ressourcen. Als eines der ersten Unternehmen in Deutschland hat Weleda freiwillig eine Umwelterklärung und einen Nachhaltigkeitsbericht vorgelegt.
Qualitäts-Produkte
Das breite Sortiment enthält 1.200 Fertig-Arzneimittel sowie ca. 120 Produkte für die Körperpflege inklusive Naturkosmetik. Zur Selbstmedikation - für Anwendungsgebiete wie Erkältungskrankheiten, Arthrosen, Verletzungen und Verbrennungen - gibt es 100 Arzneimittel. Dabei stellt man höchste Qualitäts-Anforderungen an die gesamte Herstellungskette, angefangen bei der Rohstoff-Qualität.
Prozessvalidierung und Qualifizierung
Die behördlichen Richtlinien (FDA und GMP) fordern, dass pharmazeutische Unternehmen ihre Prozesse mit Einfluss auf die Produktqualität validieren und die zugehörigen Geräte qualifizieren, um sichere (reproduzierbare) Ergebnisse garantieren zu können. Diese regulatorischen Anforderungen gelten auch für die Datenerfassung, die aus Hard- und Software bestehen. Durch die Validierung wird der dokumentierte Beweis erbracht, dass der Prozess oder das System die vorher spezifizierten Anforderungen im praktischen Einsatz erfüllen.
Bei einer Validierung in der pharmazeutischen Industrie wird am Endprodukt überprüft, ob der Prozess unter den selben Bedingungen (z. B. Temperatur) immer das beabsichtigte Ergebnis erzielt. Zur Prozessvalidierung wird ein Validierungsplan erstellt, nach dem die Prozessvalidierung durchzuführen ist. Diese wird vom zuständigen Verantwortlichen (Laborleiter oder Qualitätssicherung) geprüft und genehmigt. Für die nach diesem Plan durchgeführte Validierung wird nach der Durchführung ein Validierungsbericht erstellt, der die Ergebnisse und Abweichungen dokumentiert. Nur validierte Methoden und Prozesse dürfen zur Herstellung und Prüfung von Arzneimitteln, die für den Verkauf vorgesehen sind, verwendet werden.
Qualitätssicherung
Die Weleda Qualitätskriterien sind für alle Standorte in der Welt gültig. Sie orientieren sich am pharmazeutisch-therapeutischen Konzept der anthroposophischen Menschenkunde und werden gemäß den aktuellen spezifischen und allgemeinen Qualitätsstandards gesichert.
Für die pharmazeutischen, diätetischen und pflegenden Präparate werden natürliche Substanzen und in besonderen Fällen auch solche andere Materialien, deren Verwendung sich in ihrem Bezug zum Menschen begründen lässt, eingesetzt. Die hohen Qualitätsstandards werden durch ständige Prüfung mit modernsten chemisch analytischen Methoden (HPLC, GC) eingehalten. Erst nach Freigabe werden Rohstoffe zur Produktion zugelassen; Zwischenpräparate und Endprodukte werden ebenfalls kontinuierlich überprüft.
Langzeitstabilität
Die Stabilität wird im ersten Jahr im Abstand von drei Monaten getestet, anschließend halbjährlich und ab dem zweiten Jahr jährlich. Dabei wird die Stabilität, Abbau, Trennung der gelagerten Präparate überprüft.
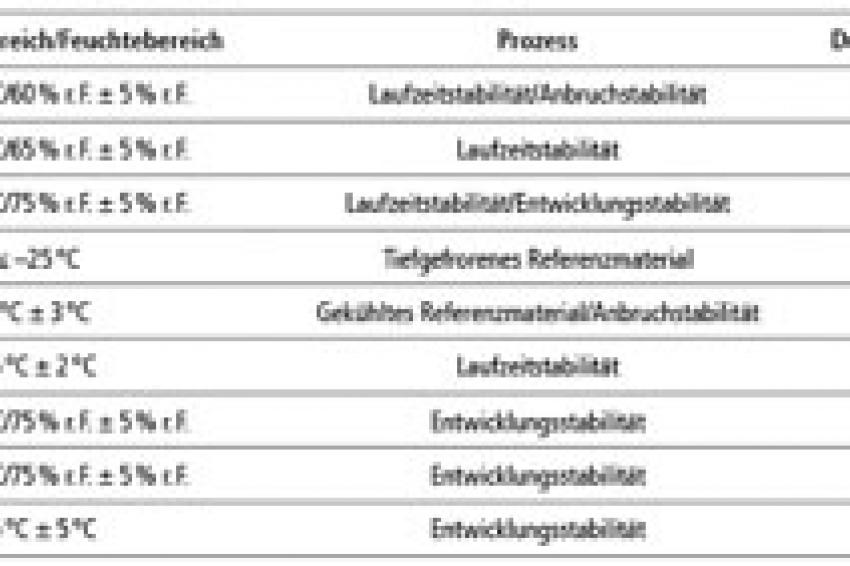
Dazu werden Arznei- sowie Kosmetikstabilitätsprüfmuster in Klimakammern und -schränken nach ICH-Richtlinien eingelagert. Die verschiedenen Temperatur- und Feuchtigkeitseinstellungen sind aus Tabelle 1 ersichtlich.
Die Temperatur- und Feuchtekonstanz ist sehr kritisch, da diese wesentliche Einflussfaktoren auf laufenden Stabilitätsstudien darstellen. Da ebenfalls Anbruchstabilitätsproben mit geringen Laufzeiten eingelagert sind (minimale Einlagerung von sieben Tagen), bei denen schon eine kurzzeitige Temperatur- bzw. Feuchteabweichung einen erheblichen Einfluss auf die Stabilitätsstudien darstellt, ist mit höchster Priorität auf Funktion der Klimaräume und -schränke zu achten. Aus diesem Grunde müssen Temperatur und Feuchtigkeit detailliert gemessen und dokumentiert werden. In den überwachten Klimaräumen und -schränken wird mit Rotronic HygroLog-NT gemessen und dokumentiert. Sämtliche Ereignisse wie eventuelle Störungen, wie Server- oder Stromausfall, Bedienereingriffe, bis hin zum Batteriewechsel werden von dem System gepuffert und registriert.
Ein rechnergestütztes System dient der Messdatenerfassung und Alarmierung. Die Hauptaufgabe des Systems ist die Überwachung der Klimakammern und Kühlschränken. Höchste Priorität gilt der Speicherung und Sicherung der erfassten Daten. Ein Datenverlust ist auszuschließen.
Pharmaunternehmen müssen laut FDA und GMP4 den Nachweis erbringen, dass die Messdaten zuverlässig erfasst und verwaltet worden sind. Dazu sind validierbare Software und Geräte notwendig. Mit den HW4-kompatiblen Geräten und Software stellt Rotronic eine validiert und mit 21 CFR Part 11 und GMP kompatibel Lösung zur Verfügung.
_______________________________________________________________________________________________________
Kurzinterview mit Herrn René Wiget, Laborleiter Corporate Analytical Services (CAS), Weleda AG
Die Arzneimittelbehörde der Vereinigten Staaten FDA und die Europäische GAMP4 Richtlinien fordern die regelmäßiges Erfassung und Dokumentation der herrschenden Raumkonditionen bei der Produktion und Lagerung von pharmazeutischen Produkten. Zur Überwachung und Dokumentation von Temperatur und Luftfeuchtigkeit Ihrer Produktionsbedingungen sowie der Langzeitstudien haben Sie nach einer neuen Lösung gesucht. Was war der treibende Grund?
René Wiget: Aufgrund der steigenden Anforderungen an Qualität der Produkte sowie den Vorgaben durch den Gesetzgeber war ein solcher Schritt notwendig. Nun sind wir in der Lage unsere hohen Qualitätsansprüche zu erfüllen sowie die regulatorische Anforderungen (FDA, GMP4) einzuhalten.
Wie lange haben Sie für die Auswahl und Implementierung des neuen Systems benötigt?
René Wiget: Nach einer Vorauswahl an möglichen Messsystemen und Lösungen haben wir einen Anforderungskatalog erstellt. Danach wurden alle Systeme analysiert und geprüft und eines ausgewählt. Im Ganzen hat das Projekt ca. ein Jahr gedauert.
Wo sehen Sie den Vorteil des neuen Systems?
René Wiget: Es sind vielen Faktoren, die bei der Auswahl eines Systems zum Tragen kommen. Meist muss man einen Kompromiss eingehen. Bei unserem Vorhaben hatte Rotronic das beste Gesamtpaket. Ein Aspekt ist die Präzision der Messgeräte sowie deren problemlose Kalibrierbarkeit. Die einfache Handhabung des Komplettsystems spielt eine große Rolle. Ein entscheidender Grund war sicherlich die lückenlose Dokumentation der Prozess- bzw. Lagerbedingungen, um den FDA und GMP Regularien zu erfüllen. Dies ist für uns ein wichtiger Schritt in Richtung weiterer Zertifizierung.