Countdown zur EU-Fälschungsrichtlinie
Wie sich Pharma-Lohnhersteller auf Februar 2019 einstellen
Nur noch wenige Monate bis zur Einführung der EU-Fälschungsrichtlinie. Dann sollen individuelle Codes den Weg von Arzneimittelpackungen transparent machen und deren Fälschung erschweren. Für Pharmaunternehmen bedeutet dies erhebliche Investitionen in IT, Verpackungstechnik und Prozessmanagement. Ein Blick hinter die Kulissen zeigt, wie sich Arzneimittelproduzenten auf den Tag X vorbereiten.
So war das nicht geplant: Eigentlich rechnete der schwedische Arzneimittelhersteller Recipharm 2013 damit, dass die Vorbereitungen auf die EU-Fälschungsrichtlinie rund 14 Mio. EUR kosten würden. Heute, mehr als fünf Jahre später, läuft das Projekt immer noch, doch die Kosten summieren sich mittlerweile auf 30 Millionen Euro, sagt Staffan Widengren, Director Corporate Projects bei dem Stockholmer Unternehmen. Bei einem Jahresumsatz von rund 550 Millionen Euro ein stattlicher Betrag.
Recipharm entwickelt und produziert im Auftrag seiner Kunden Arzneimittel – die Kurzbezeichnung für derartige Unternehmen lautet CDMO, die Abkürzung für Contract Development and Manufacturing Organization. In dieser Funktion muss sich Recipharm, wie viele andere Pharmahersteller auch, auf die Einführung der EU-Fälschungsrichtlinie am 9. Februar 2019 einstellen. Die hat zum Ziel, Medikamentenfälschern das Leben schwerer zu machen. Bis zu 200 Mrd. USD pro Jahr soll der Handel mit gefälschten Arzneimitteln wert sein. Schätzungen zufolge sollen jährlich zudem Tausende Menschen an minderwertigen Arzneimitteln sterben, manche Quellen sprechen sogar von bis zu einer Million Opfer.
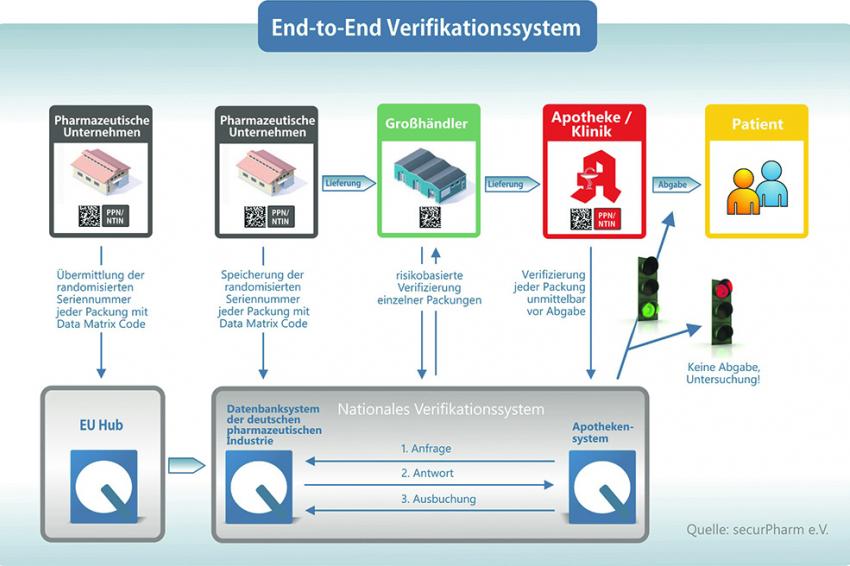
Mit Start der EU-Richtlinie dürfen pharmazeutische Unternehmen fast alle verschreibungspflichtigen Arzneimittel nur noch dann für den Verkehr freigeben, wenn sie Sicherheitsmerkmale tragen. Dabei erzeugt der Hersteller für jede Packung eine Seriennummer und speist diese in eine zentrale Datenbank ein, sobald er das Arzneimittel in die Handelskette gibt. Großhändler prüfen die Sicherheitsmerkmale bei allen Packungsrückgaben sowie bei Arzneimitteln, die nicht vom Hersteller geliefert werden. Am Ende der Kette buchen Apotheker die Präparate vor der Abgabe an die Patienten schließlich wieder aus dem System aus.
Generierung von tausenden Verifizierungscodes
Für Widengren und rund 60 weitere Kollegen von Recipharm bedeutet die Vorbereitung auf diese gesetzliche Vorgabe seit Jahren viel Arbeit, gesteht der Recipharm-Manager im Juni 2018 auf der Münchener Digitalkonferenz Futurelink. Seine Ausführungen über die technische Umsetzung gleichen einem Exkurs in komplexes Projektmanagement - immerhin beschäftigt der Lohnproduzent weltweit rund 5.000 Mitarbeiter an mehr als 20 Standorten, darunter auch das oberbayerische Wasserburg. Zudem ist die Firma in 100 Märkten aktiv. Das an der Stockholmer Börse notierte Unternehmen produziert damit nicht nur mehr als 500 Arzneien in 2.700 verschiedenen Verpackungen pro Jahr, sondern wird in Zukunft für die Kunden auch tausende Verifizierungscodes erstellen müssen. Recipharm muss damit eine Technologie implementieren, die diese Codes elektronisch erzeugt und auf die Packungen druckt. Die Firma muss aber auch dafür sorgen, dass diese Codes an die Kunden übergehen und in Datenbanksysteme in der EU und anderen Regionen eingelesen werden können.
Um sich nicht zu verzetteln, verfolgt Recipharm nach den Worten Widengrens ein einfaches, aber wirkungsvolles Konzept: Das Unternehmen entwickelte ein Standard-Programm, das es auf sämtliche betroffenen Standorte ausrollte. „Keep it simple, but compliant“, beschreibt der Manager die Architektur der hauseigenen Lösung – einfach, aber gesetzeskonform sollte sie sein. Diese Lösung umfasst den Druck des Barcodes sowie eines lesbaren Textes auf die Packungen, einen Manipulationsnachweis und spezielle Transportboxen für US-Lieferungen, versehen mit einer Seriennummer. Zu dem System gehören außerdem die IT zur Generierung und Weitergabe von Seriennummern sowie Verpackungsmaschinen mit den entsprechenden Druckmöglichkeiten und das Datenmanagement.
Teufel steckt im Detail
So simpel es klingt, die Codes zu generieren, in Datenbanksysteme einzuspeisen und auf Packungen zu drucken, so sehr liegt der Teufel im Detail. So stellen sich die Verantwortlichen von Recipharm immer wieder die Frage: Wer erzeugt die Seriennummern eigentlich – Recipharm oder der Kunde? Auch das Format der Nummern muss definiert werden, damit sie gelesen und verarbeitet werden können. Unklarheit herrscht laut Widengren gelegentlich auch über die Frage, ob die Seriennummern versendet werden können, bevor die Arzneimittel das Produktionsgebäude verlassen? Und was ist, fragt der Schwede, wenn eine Firma 10.000 Arzneimittelpackungen in den Markt gibt, aber 12.000 Codes produziert hat? Was passiert in diesem Fall mit den überschüssigen Nummern? Schließlich sind nach seiner Erfahrung auch die Auftraggeber gelegentlich eine Herausforderung: Insbesondere große Pharmaunternehmen hätten manchmal eigene Vorstellungen und wollten in den Serialisierungsprozess bei Recipharm eingreifen.
Ein wichtiger Schritt in dem Prozedere ist zudem das sogenannte Onboarding, also der Anschluss an die Datenbanksysteme. Im Fall der EU ist dies ein Anschluss der European Medicines Verification Organization (EMVO). Dieser Hub vernetzt nationale europäische Datenbanksysteme miteinander, damit jedes verifizierungspflichtige Arzneimittel in jeder Apotheke Europas auf Echtheit geprüft werden kann. In Deutschland wird dieses System durch Securpharm koordiniert, eine nach eigenen Angaben nicht-gewinnorientierte Initiative mehrerer Verbände von Herstellern, Apotheken und Pharmagroßhändler.
Auch Sebastian Poncet, Verkaufsmanager des südfranzösischen Pharmaunternehmens und Auftragsproduzenten Fareva, weist auf der Futurelink-Konferenz darauf hin, dass Serialisierung mehr als nur ein IT-Projekt ist. Die Implementierung verlange von den Unternehmen vielmehr die Zusammenarbeit von IT, Marketing, Operations, dem Qualitätsmanagement und anderen Disziplinen. Ähnlich wie Recipharm habe auch Fareva gelernt, dass die Vorbereitungen auf die Fälschungsrichtlinie ein stattliches Budget erfordern: während dem Unternehmen das Projekt anfangs als kostenfrei dargestellt worden sei, musste es schließlich 35 Millionen Euro dafür aufwenden.
Folgen für gesamte Wertschöpfungskette
Die Serialisierung hat Auswirkungen auf die gesamte Wertschöpfungskette, verrät Pasi Kemppainen, Berater des japanischen Unternehmens Santen Pharmaceutical. „Das beeinflusst die gesamte Pharma-Lieferkettenarchitektur und die Kostenstrukturen.“ Die Implementierung der Systeme sei zudem ein komplexer und teurer Prozess, bei dem nicht nur intern durch Projektmanagement, Training und Dokumentation Ressourcen gebunden werden, sondern auch durch die Zusammenarbeit mit externen IT-Dienstleistern.
Recipharm ist trotz dieser Herausforderungen ein gutes Stück vorangekommen. Nach den Worten Widengrens hat Recipharm sein System in den betroffenen Werken mittlerweile implementiert und auf Funktionstüchtigkeit geprüft. Auch die Verträge mit externen Spezialisten seien längst unter Dach und Fach, unter anderem mit der US-Digitaltechnikfirma Tracelink. Die liefert nicht nur für Pharmaunternehmen die entsprechende Serialisierungssysteme, sondern zielt auch auf Großhändler, Krankenhäuser und Apotheker.
Wichtig bei den Vorbereitungen auf die EU-Fälschungsrichtlinie ist nach Meinung Widengrens der rechtzeitige Start und die Suche nach einem kompetenten Technologiepartner. Zudem sollte der Implementierungsprozess an einer zentralen Stelle im Unternehmen aufgehängt sein, auch die Verantwortlichkeiten sollten eindeutig geregelt sein. Hilfreich sei zudem ein regelmäßiger Austausch sowohl mit den eigenen Filialen beziehungsweise Standorten wie auch mit den externen Partnern. Schließlich hält er es für wichtig, dass auch das eigene Top-Management eng in den Prozess involviert ist und ein gutes Verständnis von der Materie erwirbt.
Doch offenbar sind noch nicht alle Unternehmen ausreichend auf den 9. Februar 2019 vorbereitet. So hat Widengren festgestellt, dass einige Kunden noch deutlich hinterherhinken: „Unternehmen, die erst jetzt starten, werden möglicherweise die Deadline nicht einhalten können“, so seine Einschätzung.
Diese Beobachtung hat auch Serialisierungsberater Kemppainen gemacht. Trotz der fortgeschrittenen Zeit seien nur wenige Unternehmen wirklich gut vorbereitet. Kemppainen: „Das ist besorgniserregend.“ Und Oliver Nürnberg, Chief Product Owner SAP Life Sciences beim Walldorfer Softwareriesen SAP, einem Schwergewicht bei Software für Pharmakonzerne, hat festgestellt, dass auch in der Pharma-Vertriebskette noch erhebliches Nachholpotenzial besteht. Insbesondere Händler und Apotheken seien „noch recht weit weg“ von dem Thema. Immerhin, für Nachzügler bieten einige IT-Firmen sogenannte Expresspakete an, mit denen die Anforderungen an die künftigen europäischen Richtlinien beziehungsweise der Anschluss an den EU-Hub gelingen sollen. Das, soviel ist sicher, wird aber nicht billig.