Biologisch aktive Peptide aus Cyanobakterien
Eine wertvolle Quelle nicht-toxischer bioaktiver Substanzen
Cyanobakterien sind eine reiche Quelle an biologisch aktiven Peptiden. Neben den hepatotoxischen Microcystinen findet man zahlreiche nicht-toxische Peptide. Von den Elastase-hemmenden zyklischen Scyptolinen aus Scytonema hofmanni kennt man heute die Kristallstruktur des Peptid-Enzym Komplexes. Vergleichbares gilt für die "angiotensin converting enzyme" (ACE)-hemmenden linearen Microginine aus Microcystis sp. Der Fundus an cyanobakteriellen Peptiden von pharmakologisch-biotechnologischem Interesse ist längst nicht erschöpft.
Cyanobakterien
Die heutigen Cyanobakterien haben phylogenetisch besondere Bedeutung. Vor ca. 2-3 Milliarden Jahren wurde durch die oxygene Photosynthese der Cyanobakterien die damalige anaerobe in die heutige aerobe Erdatmosphäre umgewandelt, Cyanobakterien waren die Vorläufer der Chloroplasten der höheren Pflanzen. Cyanobakterien besetzen heute ubiquitär die verschiedensten Biotope, als Symbionten und Stickstoff-Binder sind sie von landwirtschaftlicher Bedeutung.
Einige Cyanobakterien werden als Nahrungsmittel-Zusatz eingenommen (z. B. Spirulina- oder Nostoc-Arten), als „Wasserblüten" können sie auffallende Massenansammlungen bilden. Diese können aufgrund toxischer Peptide giftig sein (Abb. 1), oft sind sie jedoch eine Quelle an wertvollen nicht-toxischen bioaktiven Peptiden, wie aus dem Folgenden hervorgeht.
Peptide aus Cyanobakterien
Cyanobakterien produzieren eine Vielzahl an sekundären Stoffwechselprodukten mit breiter biologischer Wirksamkeit. Die Vielfalt reicht von spezifischer und potenter Enzym-Hemmung, über antibiotische Aktivität bis hin zu herzwirksamer, immunsuppressiver oder zytotoxischer Wirkung. Aufgrund der breiten pharmakologischen Wirksamkeit wurden in den letzten Jahren mit Cyanobakterien zahlreiche Screenings nach neuen, geeigneten Leitsubstanzen durchgeführt. Beispiele sind die Laxaphycine aus Anabaena laxa, zyklische Peptide, die als Kombinationspräparate antifungal wirksam sind. Aus Scytonema mirabile kennt man die Tantazole und Mirabazole, die selektiv zytotoxisch für solide Tumore sind. Eine Vielfalt an Strukturen, die vermutlich durch symbiontisch lebende Cyanobakterien produziert werden, wurde insbesondere aus marinen Schwämmen isoliert [1].
Die Synthese der cyanobakteriellen Peptide ist nicht-ribosomal. Mittlerweile finden sich Gene der Peptid-Synthetasen in den meisten Cyanobakterien, und es werden molekulare Techniken zur Detektion Toxin bildender Arten entwickelt [2]. Bei der Fülle der inzwischen bekannten Strukturen sei hier nur auf eine selektive Auswahl eingehender untersuchter Peptide eingegangen. Auf die nicht-peptidischen Neurotoxine wie Anatoxine, Aphantoxine und Lyngbyatoxine sei hier nur verwiesen.
Microcystine und Nodularine
Ursprünglich konzentrierte sich das Interesse auf die Microcystine aus Microcystis aeruginosa, hepatotoxische zyklische Peptide mit Tumorpromotor-Aktivität. Microcystine binden kovalent an die Protein-Phosphatasen PP1 und PP2A [3] von Hepatocyten mit der Folge des Zusammenbruchs des Zytoskeletts (IC50 = 0,1-0,25 nM). Den Microcystinen strukturell ähnlich und ebenfalls hepatotoxisch sind die Nodularine aus Nodularia spumigena. Auch diese Peptide hemmen spezifisch Protein-Phosphatasen.
Cyanopeptoline
Cyanopeptoline sind zyklische cyanobakterielle Depsipeptide mit überwiegend Protease-inhibitorischer Wirkung (Abb. 2). Gut untersucht sind die Elastase-hemmenden Scyptoline aus Scytonema hofmannii. Elastase ist an der Aufrechterhaltung des Bindegewebes beteiligt. Ein Ungleichgewicht zwischen Enzym und natürlichem Inhibitor führt zu Krankheitsbildern mit exzessiver Proteolyse wie Pancreatitis, Arthritis, Emphysemen, cystischer Fibrose oder Psoriasis.
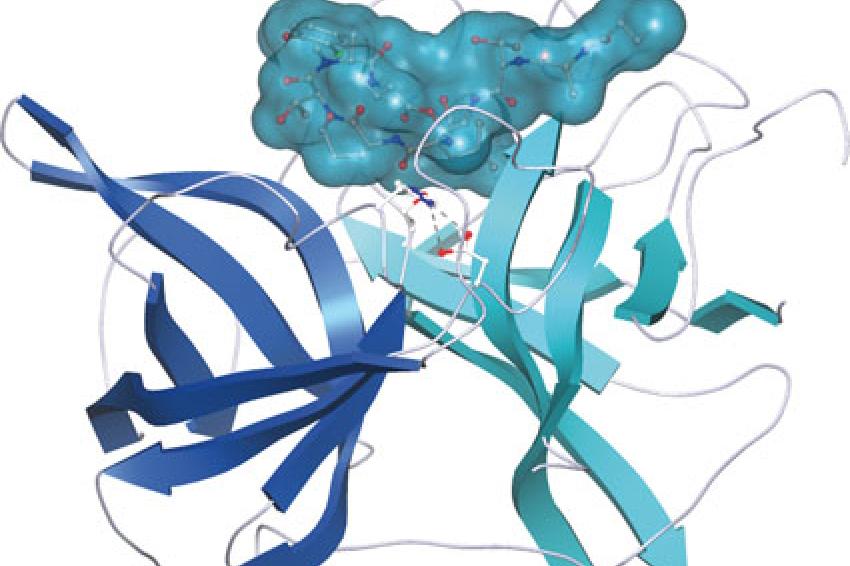
Die Interaktion von Scyptolin A mit Elastase aus Schweine-Pancreas wurde inzwischen röntgenspektroskopisch aufgeklärt [4, Abb. 3]. Dies ist deshalb von Bedeutung, da dieses Enzym der neutrophilen Elastase ähnelt, die als Zielenzym für Medikamente attraktiv ist. Das Peptid blockiert mit seiner rigiden Ringstruktur die prominenten Positionen S1-S4 des Enzyms. Ein Vergleich mit der Bindungsstruktur von Cyanopeptolin A90720A aus Microchaeta loctakensis [5], einem Trypsin Inhibitor aus dem Rinder-Pankreas belegt eine nahezu identische Konformation der beiden Cyanopeptolin-Ringe in den Kristallen, trotz der verschiedenen Zielenzyme.
Microginine
Auch lineare cyanobakterielle Peptide sind als Protease-Inhibitoren bekannt. Microginin FR1 (Abb. 4) ist ein Inhibitor des an der Blutdruckregulierung beteiligten Angiotensin Converting Enzyms mit einem IC50 = 10 μm. Die Microginine hemmen ferner Leucin-Aminopeptidasen, die an vielen Stoffwechselwegen beteiligt sind, u.a. an der Metastasenbildung, an der Antigenpräsentation, an der Hormon- und Botenstoff-Synthesen oder an Bluthochdruck.
Kürzlich wurde durch Co-kristallisation von Leucin-Aminopeptidase aus der Kälberlinse (bLAP) mit Microginin FR1 die molekulare Wechselwirkung des Enzym-Inhibitor-Komplexes aufgeklärt [6, Abb. 5]. Durch Überlagerung mit dem ACE-Inhibitors Lisinopril im ACE : Lisinopril-Komplex konnte auch die mögliche Bindung von Microginin FR1 an das aktive Zentrum von ACE diskutiert werden [6, 7].
Ökologische Bedeutung. Pharmakologisch-biotechnologische Anwendung
Über die ökologische Bedeutung der cyanobakteriellen Peptide ist kaum Gesichertes bekannt. Man nimmt an, dass sie als Fraßabschreckung dienen könnten. Cyanobakterien, die in Gemeinschaft mit Bakterien oder Diatomeen leben, exprimieren oft ein breites Spektrum an Peptiden. Der Vorteil der Breite und Variabilität der verschiedenen Peptid-Metabolite ist offensichtlich.
Peptide beeinflussen auch das Plankton [8]. Die Toxinproduktion in Microcystis aeruginosa erhöht sich, wenn das Cyanobakterium dem Zooplankton ausgesetzt wird. Wasserpflanzen reagieren bei der Inkubation mit Microcystinen mit vermindertem Wachstum und Abnahme des Chlorophyll Gehalts [9]. Proteasen aus dem Darm von Daphnien werden durch cyanobakterielle Peptide stärker gehemmt als analoge Proteasen aus Rindern oder Schweinen [9].
Für die pharmakologisch-biotechnologische Forschung können die Peptide aus Cyanobakterien aufgrund ihrer strukturellen Vielfalt und Wirksamkeit für die Entwicklung von natürliche bioaktiven Wirkstoffen dienen. Das gilt sowohl für die Phosphatase-Inhibitoren als auch für die selektiv und potent wirksamen Protease-Hemmstoffe.
Eine Reihe der genannten Cyanopeptoline können als Serin-Proteasen-Inhibitoren für die pharmazeutische Forschung lohnend sein. Die für die Elastase-Hemmung erkannte Bindungsstruktur von Scyptolin A könnte dazu beitragen, potente synthetische Elastase-Inhibitoren zu entwickeln. Die Peptidgruppe der linearen Microginine als Inhititoren von ACE und Aminopeptidasen sind von besonderem pharmakologischem Interesse, zumal die Totalsynthese von Microginin möglich ist.
Referenzen
[1] Burja A. M. et al.: Tetrahedron 57, 9347-9377 (2001)
[2] Dittmann E. et al.: Toxicol. & Appl. Pharmacol. 203, 192-200 (2005)
[3] Goldberg J. et al.: Nature. 376, 745-53 (1995)
[4] Matern U. et al.: Chem. Biol. 10, 997-1001 (2003)
[5] Lee A. Y. et al.: J. Chem. Biol. 1, 113-117 (1994)
[6] Kraft M. et al.: Chem. Biol. 10, 997-1001 (2003)
[7] Natesh R. et al.: Nature 421, 551-554 (2003)
[8] Rohrlack T. et al.: Appl. & Env. Microbiol. 70, 5047-5050 (2004)
[9] Pflugmacher S.: Environ. Toxicol. 17, 407-413 (2002)
[10] Agrawal M. K. et al.: Environment. Toxicol. 20, 314-322 (2005)
Kontakt
Albert-Ludwigs-Universität Freiburg
Fahnenbergplatz
79085 Freiburg
Deutschland
+49 761 203 98604