Das nächste Level der klinischen Forschung
Weil die Datenmenge zunimmt, müssen Effizienz, Qualität und Geschwindigkeit verbessert werden
Während einige Bereiche nahe dran sind an einer digitalen Revolution, lassen sich bei anderen Themen noch gar keine Veränderungen feststellen. Fakt ist: In klinischen Studien der Phase III sammeln Unternehmen heute im Durchschnitt dreimal mehr Daten als noch vor zehn Jahren.
Da klinische Studien immer komplexer werden, besteht ein dringender Bedarf, die Effizienz, Qualität und Geschwindigkeit der Prozesse zu verbessern. Hiervon sind auch Auftragsforschungsinstitute (Contract Research Organizations, CROs) betroffen. Veeva Systems hat aus den Gesprächen mit Führungskräften der Auftragsforschungsinstitute KCR, Bioforum the Data Masters und Syneos Health die folgenden Thesen abgeleitet.
Traditionelle EDC-Systeme werden weiterentwickelt – oder gänzlich verschwinden
Die Art und Weise, wie Pharmaunternehmen und CROs Informationen in herkömmlichen elektronischen Datenerfassungssystemen (Electronic Data Capture, EDC) erfassen und speichern, muss sich weiterentwickeln, um im Zeitalter der Echtzeitinformationen und des ferngesteuerten Monitorings relevant zu bleiben. Die meisten herkömmlichen EDC-Systeme sind lediglich digitale Darstellungen von Fallberichtsformularen (Case Reform Forms, CRFs) auf Papier. Studienteams geben nach jedem Patientenbesuch die Daten in die herkömmlichen EDC-Systeme ein, sind aber nicht in der Lage, das Gesamtbild zu überblicken, da Daten aus Quellen wie Wearables, elektronischen Patientenberichten (ePRO) und Geräte zum ferngesteuerten Monitoring ausgeschlossen sind.
Da 75 % der Daten aus klinischen Studien inzwischen außerhalb von EDC-Systemen erfasst werden, benötigen Datenmanager eine bessere Möglichkeit, nichtkonventionelle Daten in großem Umfang zu verwalten. Sie benötigen Tools, mit denen sie sämtliche klinischen Daten zusammenführen und harmonisieren können, damit diese schneller einsatzbereit sind.
„Das Potenzial, die klinische Forschung auf das nächste Level zu heben, ist hoch, wird aber noch nicht voll ausgeschöpft.“
Digitalisierung fängt bereits beim Design klinischer Studien an
Standardisierte Arbeitsanleitungen für die Durchführung klinischer Prüfungen mit Arzneimitteln und Medizinprodukten (Standard Operating Procedures, SOPs) werden häufig aus einer traditionellen Denkweise heraus verfasst. Das bedeutet, die SOPs sind generisch und unflexibel und berücksichtigen nicht die Möglichkeiten und Anforderungen zunehmend digitaler Studien. Es ist umgekehrt schwierig, einmal festgelegte SOPs und Protokolle zu ändern, um neue Technologien einzubeziehen.
Um den größtmöglichen Nutzen aus Technologien zu ziehen, sollten Sponsoren und CROs vom ersten Tag an zusammenarbeiten, um Protokolle mit Blick auf digitale Studien zu entwerfen. Dies erfordert eine flexible Denkweise, um den sich ändernden Patientenbedürfnissen und Studienanforderungen gerecht zu werden und gleichzeitig regelkonform zu sein. Die Digitalisierung sollte im kompletten Lebenszyklus einer klinischen Studie integriert sein. Neue Technologien, Mitarbeiterschulungen für deren Einsatz und SOPs – alle Bereiche sollten eng miteinander verwoben sein.
Maschinelles Lernen wird den Aufwand der Datenverwaltung verringern
Datenverwalter stehen unter dem ständigen Druck, in immer kürzerer Zeit hochwertige Ergebnisse zu erzielen. Hierfür müssen sie Daten aus unzähligen Quellen zusammentragen.
Lösungen wie elektronische Einverständniserklärungen (eConsent), die elektronischen Bewertungen klinischer Ergebnisse (Electronic Clinical Outcome Assessments, eCOA) und als wichtiger Baustein derselben die von Patienten verfassten Berichte (in der Anwendung Electronic Patient Reported Outcomes, ePRO) machen Papierformate zunehmend obsolet. Gleichzeitig führen sie zu neuen und umfassenden Datenmaterialien. Daten werden zudem aus mobilen Geräten und Smartphone-Apps generiert.
Diese Entwicklung erfordert einen rationalisierten Ansatz, um die zunehmend digitalen Daten bereinigen und verwalten zu können. Einige CROs prüfen deshalb, inwiefern sich Prozesse automatisieren lassen, um tägliche, sich wiederholende und zeitraubende Aufgaben abzuschaffen. Zu den Aktivitäten, die sich für eine Automatisierung eignen, zählen, Erhebungsbögen zu erstellen (Case Report Forms, CRFs), Metadaten zu verwalten, die Datensätze zu konvertieren, Daten zu bereinigen und die Leistungen der unterschiedlichen Forschungsstandorte abzurechnen. Insbesondere die Datenbereinigung inklusive manueller Überprüfungen lässt sich mithilfe von KI und maschinellem Lernen optimieren.
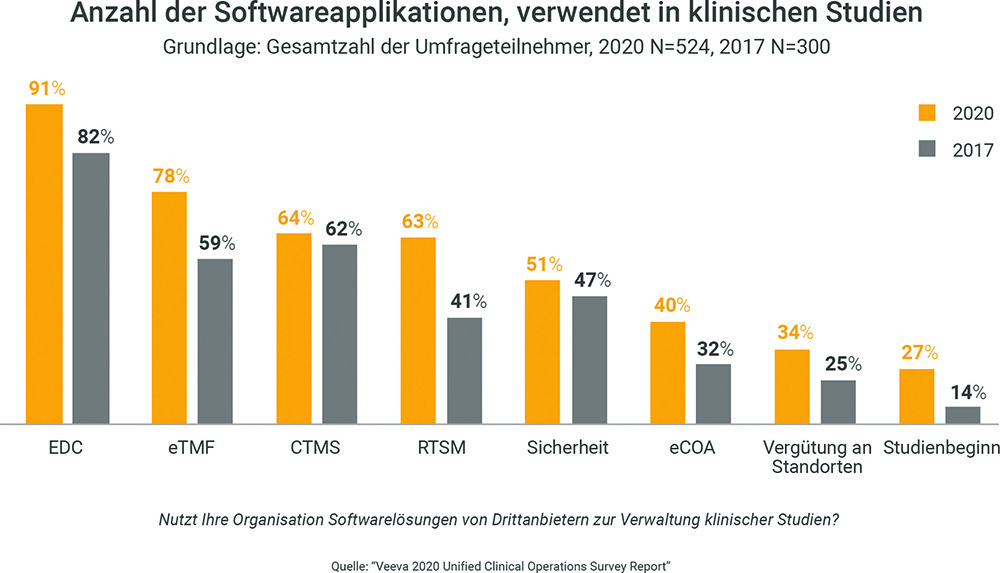
Zentrale Datenplattformen werden modulare Softwarestrategien ersetzen
Eine von Veeva 2020 durchgeführte Untersuchung hat ergeben, dass Fachleute für klinische Abläufe im Durchschnitt fünf oder sechs verschiedene Softwareapplikationen einsetzen, um klinische Studien zu verwalten. So verwenden die meisten Sponsoren und CROs ein EDC-System zur Datenerhebung. Darüber hinaus führen immer mehr Unternehmen klinische Studienmanagementsysteme ein (Clinical Trial Management System, CTMS), Systeme für die Randomisierung und das Beschaffungsmanagement von Studien (Randomization Trial Supply Management System, RTSM) und Lösungen zur elektronischen klinischen Ergebnisbewertung (eCOAs).
Beim Einsatz verschiedener Softwaresysteme und -anwendungen kann es zu unvorhersehbaren Integrations- und Verwaltungsproblemen kommen – insbesondere für die Prüfzentren. Diese tragen in der Regel die größte Last bei der Adaption neuer Technologien. Das Auftragsforschungsinstitut KCR berichtete bspw. von einer durchaus problematischen Entwicklungskurve. So habe man zunächst Daten auf dem Papier verwaltet und dann nach und nach immer mehr auf technologische Lösungen gesetzt. Das wiederum habe zu etlichen Problemen geführt, sodass irgendwann die Erkenntnis reifte: Es ist an der Zeit, die Prozesse zu vereinfachen. Ein plattformbasierter Ansatz hat nicht nur das Potenzial, einige dieser Probleme zu lösen, sondern kann auch die Kontrolle von Studien und das Reporting verbessern.
Fazit
Das Potenzial, die klinische Forschung auf das nächste Level zu heben, ist hoch, wird aber noch nicht voll ausgeschöpft. Das liegt zum einen daran, dass die technologische Entwicklung so rasant ist, dass Entscheider der Life-Sciences-Industrie schlicht und einfach nicht immer alle vorliegenden Lösungen kennen. Zum anderen ist mit dem Einsatz neuer Technologien auch ein gewisser Aufwand verbunden, bestehende Systeme entsprechend umzustellen, Prozesse zu adaptieren und die Belegschaft zu schulen. Traditionell unterliegt die Pharmaindustrie strengen Regularien. Es bedarf demnach Compliance aber auch Ressourcen und manchmal den Mut, neue Wege zu gehen.
Hier hat sich in den vergangenen Jahren auf Seiten der Sponsoren bereits viel geändert. So ist man bspw. davon abgerückt, neue Lösungen im Rahmen von Pilotprojekten zu testen, die anschließend häufig im Sand verlaufen sind. Bedingt auch durch die Covid-Pandemie sind Unternehmen eher dazu bereit, neue Technologien umfassend für sämtliche Studien einzusetzen sowie einen Plattformansatz zu verfolgen. Verstärkt wird dieser Trend durch eine wesentlich engere Zusammenarbeit mit den Behörden, die Regularien seit der Pandemie flexibler definiert. Dennoch ist hier auf beiden Seiten noch Spielraum vorhanden, um die Weichen in die richtige Richtung zu stellen.
Autor: Werner Engelbrecht, Senior Director Strategy, Veeva Systems, Wien, Österreich
ZUR PERSON
Werner Engelbrecht ist Anfang 2020 als Clinical Strategist bei Veeva eingestiegen. Zuvor war er Prüfarzt und Assessor für Impfstoffe bei der österreichischen Zulassungsbehörde sowie bei Auftragsforschungsinstituten und in der Pharmaindustrie (u.a. bei GSK, Servier, Boehringer Ingelheim, IQVIA und Covance) tätig. Er hat einen medizinischen, juristischen und IT-Hintergrund und mehr als 23 Jahre Berufserfahrung. Sein Wissen deckt den gesamten Prozess der Medikamentenentwicklung ab. Er berät zudem Start-ups im Gesundheitswesen- und im IT Bereich.














